Principios Termodinámicos
Para entender, de forma fácil, el amplio y complejo mundo de la Termodinámica, se recomienda ir paso a paso comenzando con repaso de términos básicos, una introducción a los principios termodinámicos, para luego estudiar con más profundidad las leyes termodinámicas, cómo se expresan matemáticamente y sus aplicaciones.
Con las cuatro leyes de la termodinámica (ley cero, primera ley, segunda ley y tercera ley), se describe cómo funcionan las transferencias y transformaciones de energía entre distintos sistemas; siendo la base para comprender muchos fenómenos físico-químicos de la naturaleza.
Repaso de conceptos básicos
Te invitamos a ver el artículo TERMODINÁMICA, qué es y sus aplicaciones

Puedes complementar esta información con el articulo La Potencia de la Ley de Watt (Aplicaciones – Ejercicios) Por ahora SEGUIMOS…
Formas de Energía
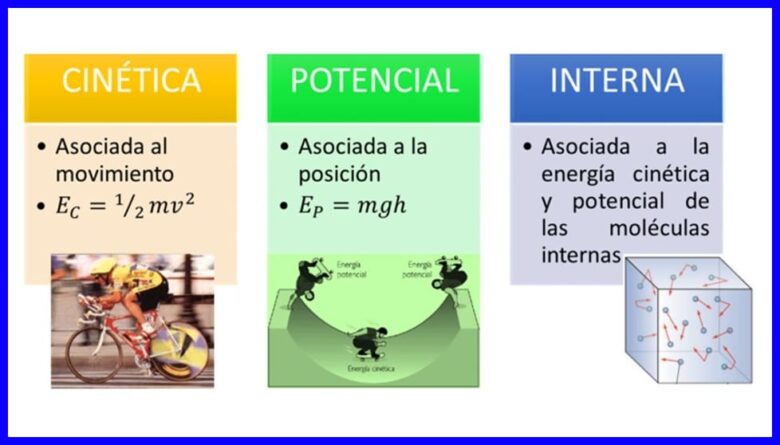
La energía, propiedad de los cuerpos de transformarse modificando su situación o estado se presenta en muchas formas, tales como la energía cinética, la energía potencial y la energía interna de los cuerpos. Ver figura 1.
Trabajo
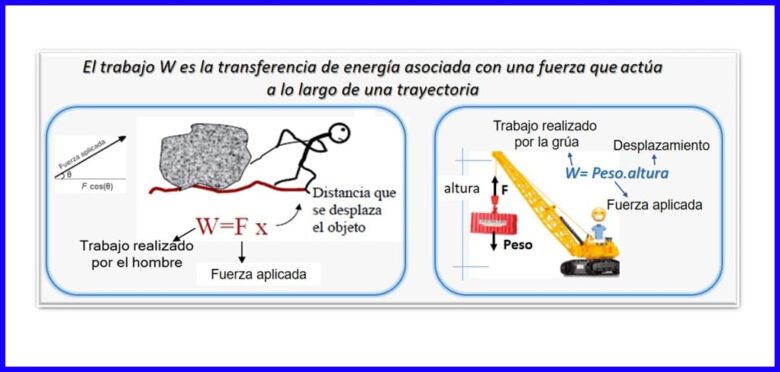
Es el producto de una fuerza por el desplazamiento, medidos ambos en la misma dirección. Para el cálculo del trabajo se utiliza la componente de la fuerza que es paralela al desplazamiento del objeto. El trabajo se mide en N.m, Joule (J), pie.lb-f o en BTU. Ver figura 2.
Calor (Q)
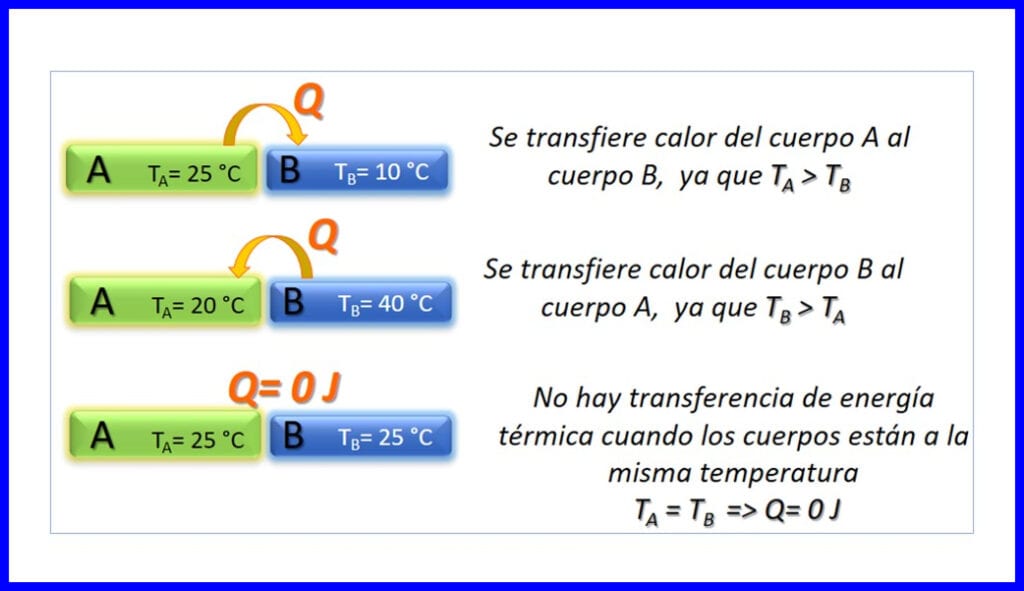
Transferencia de energía térmica entre dos cuerpos que están a diferentes temperaturas, y sólo ocurre en el sentido en que disminuye la temperatura. El calor se mide en Joule, BTU, libras-pie, o en calorías. Ver figura 3.
Principios Termodinámicos
Ley Cero – Principio Cero
La ley cero de la termodinámica establece que si dos objetos, A y B, están en equilibrio térmico entre sí, y el objeto A está en equilibrio con un tercer objeto C, luego el objeto B está en equilibrio térmico con el objeto C. El equilibrio térmico se presenta cuando dos o más cuerpos se encuentran a la misma temperatura. Ver figura 4.
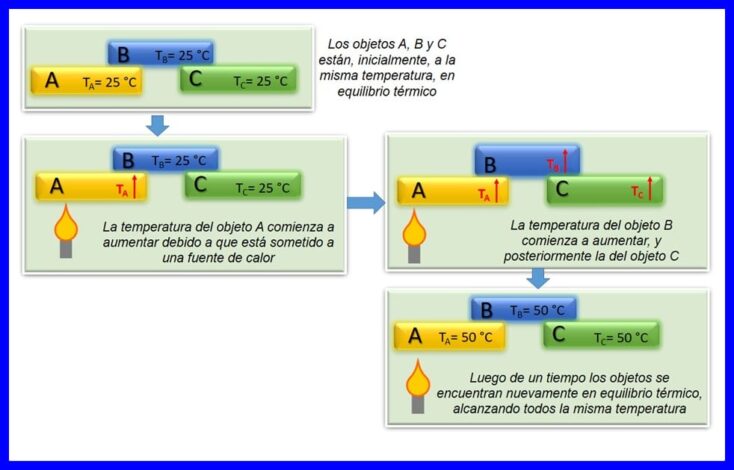
Esta ley, se considera una ley básica de la termodinámica. Fue postulada como “Ley cero”, en el año 1935, ya que se postuló después de que se hiciera con la primera y segunda ley de termodinámica.
1era Ley de la Termodinámica (Principio de la conservación de la energía)
Enunciado de la Primera Ley de la Termodinámica:
La primera ley de la termodinámica, también conocida como principio de conservación de la energía, establece que la energía no se crea ni se destruye, sólo se transforma en otro tipo de energía, o se transfiere de un objeto a otro. Así la cantidad total de energía en el universo no cambia.
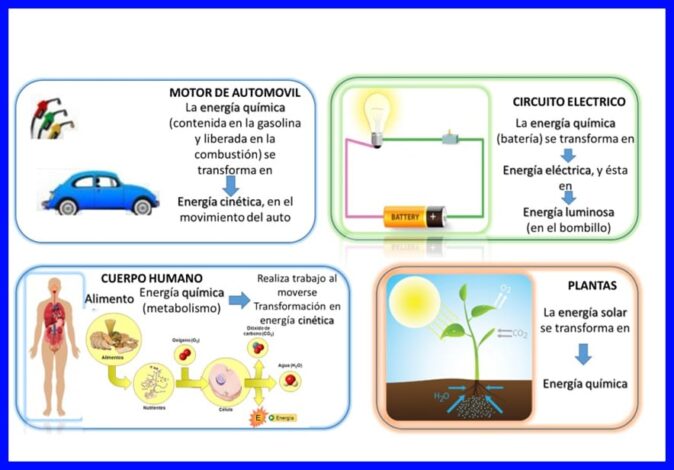
La primera ley se cumple en “todo”, la energía se transfiere y se transforma continuamente, por ejemplo, en algunos artefactos eléctricos, como las batidoras y licuadoras, se transforma la energía eléctrica en energía mecánica y térmica, en el cuerpo humano se transforman la energía química de los alimentos que se ingieren en energía cinética cuando el cuerpo está en movimiento, u otros ejemplos como los mostrados en la figura 5.
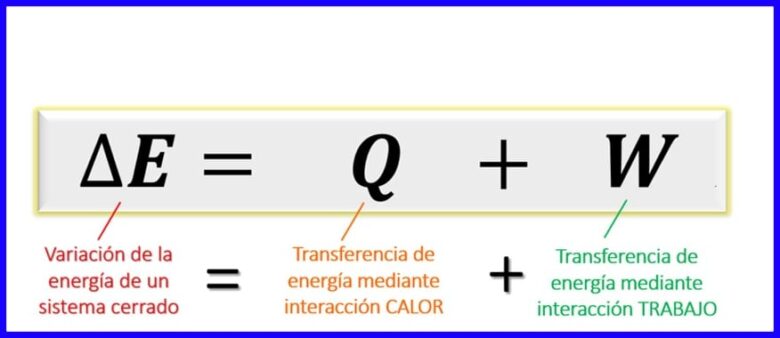
Ecuación de la Primera Ley de la Termodinámica:
La ecuación de la primera ley dentro de los principios termodinámicos expresa el balance que debe existir entre los diferentes tipos de energía en un proceso determinado. Ya que, en sistemas cerrados [1], los intercambios de energía se pueden dar únicamente por la transferencia de calor, o por el trabajo realizado (por o sobre el sistema) se establece que la variación de energía de un sistema es igual a la suma de las transferencias de energía mediante el calor y mediante el trabajo. Ver figura 6.
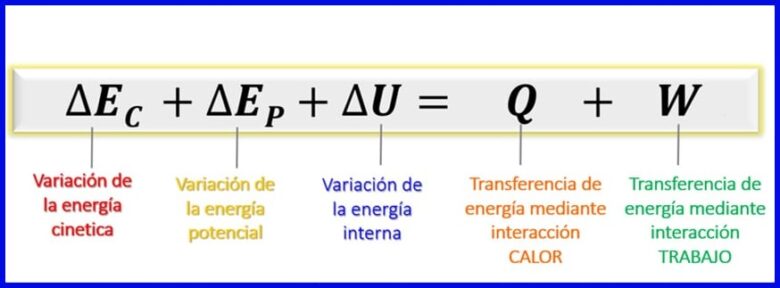
Considerando que las energías que se consideran en este balance energético son la energía cinética, la energía potencial y la energía interna [1], el balance energético, para sistemas cerrados queda como se muestra en la figura 7.
- (Ec) Energía Cinética , debido al movimiento de un cuerpo;
- (Ep) Energía Potencial , debida a la posición de un cuerpo en un campo gravitacional;
- (U) Energía Interna , debida a las contribuciones microscópicas de la energía cinética y potencial de las moléculas internas de un cuerpo.
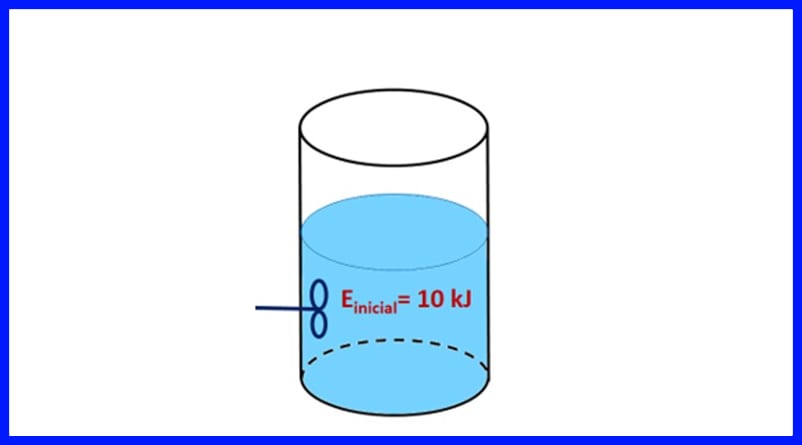
Ejercicio 1.
Un recipiente sellado contiene una sustancia, con una energía inicial de 10 kJ. La sustancia se agita con una hélice que realiza un trabajo de 500 J, mientras que una fuente de calor le transfiere a la sustancia 20 kJ de calor. Además, durante el proceso se liberan al aire 3kJ de calor. Determinar la energía final de la sustancia. Ver figura 8.
Solución:
En la figura 9 se puede observar el calor añadido por la fuente calor, el cual se considera “positivo” ya que incrementa la energía de la sustancia, el calor que se libera al aire, negativo ya que disminuye la energía de la sustancia, y el trabajo de la hélice, que al incrementa la energía tomo signo positivo.
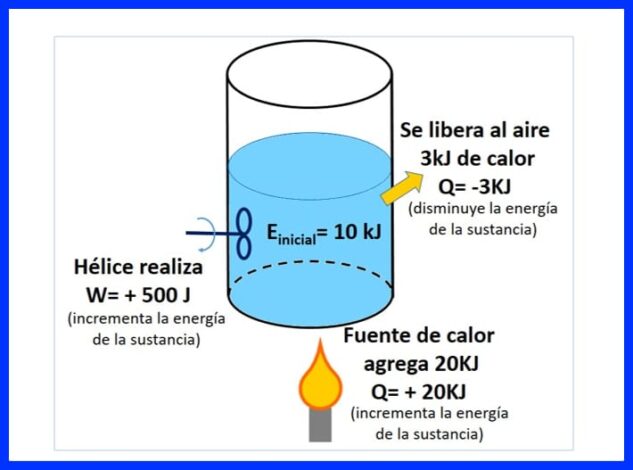
En la figura 10 se plantea el balance energético, según la primera ley de la termodinámica y se obtiene la energía final de la sustancia.

Segunda ley de la Termodinámica
Existen varios enunciados de la segunda ley de termodinámica: Enunciado de Planck-Kelvin, Clausius, Carnot. Cada uno de ellos muestra un aspecto distinto de la segunda ley. En general la segunda ley de la termodinámica postula:
- La dirección de los procesos termodinámicos, irreversibilidad de los fenómenos físicos.
- La eficiencia de las maquinas térmicas.
- Introduce la propiedad “entropía”.
Dirección de los procesos termodinámicos:
De forma espontánea en la naturaleza, la energía fluye o se transfiere desde el estado de mayor energía al de menor energía. El calor fluye de los cuerpos calientes a los cuerpos fríos y no al contrario. Ver figura 11.

Eficiencia o rendimiento térmico:
Según la primera ley de termodinámica, la energía no se crea ni se destruye, pero puede transformarse o transferirse. Pero en todas las transferencias o transformaciones de energía una cantidad de la misma no es útil para realizar trabajo. Al transferirse o transformarse la energía, parte de la energía inicial se libera como energía térmica: la energía se degrada, pierde calidad.
En toda transformación energética la cantidad de energía que se obtiene es siempre menor que la energía suministrada. La eficiencia térmica es la cantidad de calor de la fuente que se convierte en trabajo, la relación entre la energía útil obtenida y la energía aportada en una transformación. Ver figura 12.

Maquina Térmica o Maquina de calor:
La máquina térmica es un dispositivo convierte parcialmente el calor en trabajo o energía mecánica, para ello se requiere de una fuente que suministre calor a alta temperatura.
En las maquinas térmicas se utiliza de una sustancia como el vapor de agua, el aire o combustible. La sustancia sufre una serie de transformaciones termodinámicas de forma cíclica, para que la máquina pueda funcionar de forma continua.
Ejercicio 2.
El motor de un vehículo de carga produce calor en la combustión al quemar gasolina. Por cada ciclo del motor, el calor de 5 kJ se convierte en 1kJ de trabajo mecánico. ¿Cuál es la eficiencia del motor? ¿Cuánto calor se desecha por cada ciclo del motor? Ver figura 13
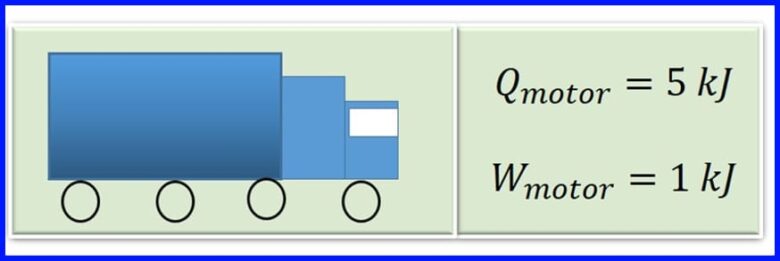
Solución:

Para determinar el calor liberado, se parte de que en las maquinas térmicas el trabajo neto es igual a la transferencia de calor neto al sistema. Ver figura 14.

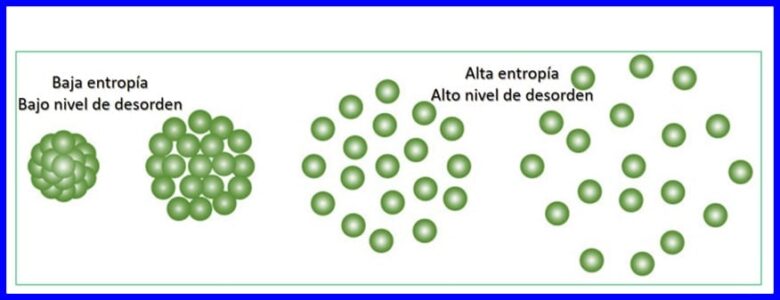
Entropía:
La entropía es el grado de aleatoriedad o desorden en un sistema. La entropía permite cuantificar la parte de la energía que no puede utilizarse para producir trabajo, es decir, permite cuantificar la irreversibilidad de un proceso termodinámico.
Cada transferencia de energía que se produce aumenta la entropía del universo y reduce la cantidad de energía utilizable disponible para realizar trabajo. Cualquier proceso termodinámico procederá en una dirección que aumente la entropía total del universo. Ver figura 15.
3era Ley de la Termodinámica
Tercera Ley de la Termodinámica o Postulado de Nerst
La tercera ley de la termodinámica está relacionada con la temperatura y el enfriamiento. Establece que la entropía de un sistema en el cero absoluto, es una constante definida. Ver figura 16.
El cero absoluto es la temperatura más baja por debajo de la cual ya no existe una medida menor, es lo más frio que un cuerpo puede estar. El cero absoluto es 0 K, equivalente a -273,15 ºC.

Conclusión
Son cuatro los principios termodinámicos. En el principio cero se establece que el equilibrio térmico se presenta cuando dos o más cuerpos se encuentran a la misma temperatura.
La primera ley de termodinámica trata sobre la conservación de la energía entre los procesos, mientras que la segunda ley de la termodinámica trata sobre la direccionalidad de menor a mayor entropía, y a la eficiencia o rendimiento de las maquinas térmicas que convierten el calor en trabajo.
La tercera ley de la termodinámica está relacionada con la temperatura y el enfriamiento, establece que la entropía de un sistema en el cero absoluto, es una constante definida.