熱力學原理
為了輕鬆理解熱力學的廣闊而復雜的世界,建議分步驟進行,首先回顧基本術語,介紹熱力學原理,然後更深入地研究熱力學定律,它們如何用數學表示及其應用。
利用熱力學的四個定律(零定律,第一定律,第二定律和第三定律),描述了不同系統之間的能量傳遞和轉換是如何工作的。 是理解自然界許多物理化學現象的基礎。
基本概念複習
我們邀請您看這篇文章 熱力學,它是什麼及其應用

您可以在文章中補充此信息 瓦特定律的力量(應用-練習) 現在 我們關注...
能量形式
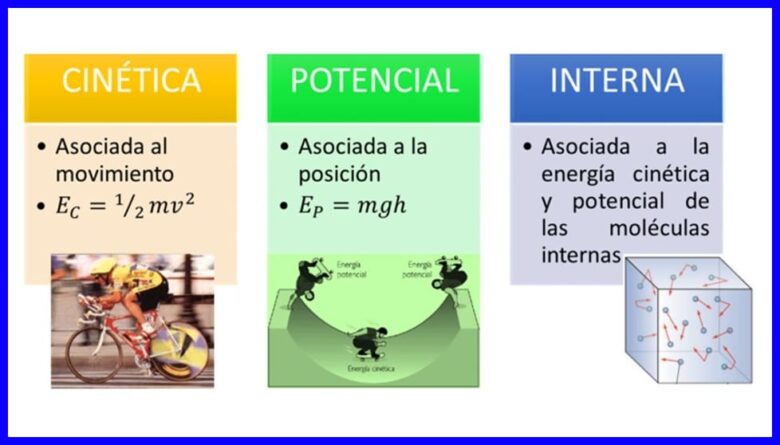
能量是身體通過改變其處境或狀態來改變自身的屬性,其形式多種多樣,例如 物體的動能,勢能和內能。 參見圖1。
工作
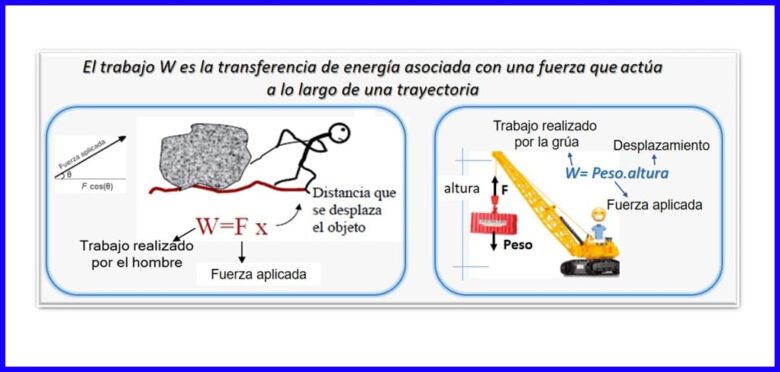
它是力和位移的乘積,兩者都是在同一方向上測量的。 為了計算功,使用了與對象位移平行的力的分力。 功的單位為Nm,焦耳(J),ft.lb-f或BTU。 參見圖2。
熱量(Q)
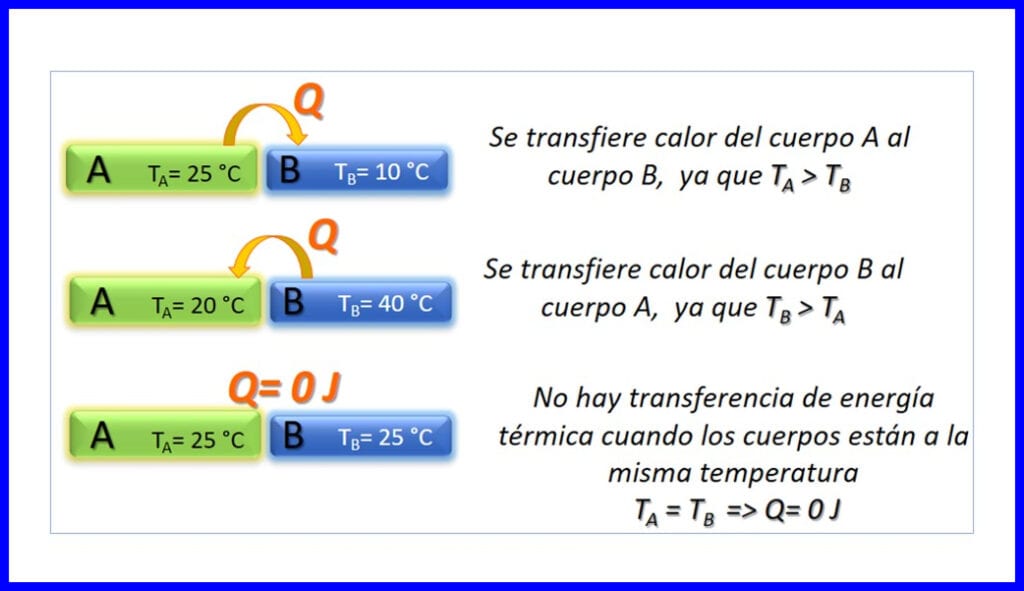
熱能在溫度不同的兩個物體之間的傳遞,僅在溫度降低的意義上發生。 熱量以焦耳,BTU,磅英尺或卡路里為單位。 參見圖3。
熱力學原理
零法則-零原則
熱力學的零定律規定,如果兩個對象A和B彼此處於熱平衡狀態,並且對象A與第三個對象C處於平衡狀態,則對象B與對象C處於熱平衡狀態。當兩個或多個物體處於相同溫度時。 參見圖4。
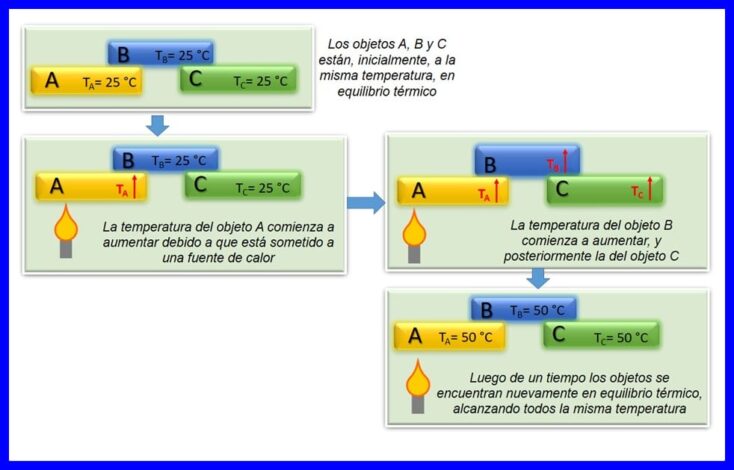
該定律被認為是熱力學的基本定律。 1935年被假定為“零定律”,因為它是在熱力學第一定律和第二定律產生之後被假定的。
熱力學第一定律(能量守恆原理)
熱力學第一定律的陳述:
熱力學的第一定律,也稱為能量守恆原理,規定能量不會產生或破壞,它只會轉化為另一種能量,或者是從一個物體轉移到另一個物體。 因此,宇宙中的總能量不會改變。
第一定律在“一切”中得到滿足,能量不斷地傳遞和轉換,例如,在某些電氣設備中,例如混合器和攪拌器,電能被轉換為機械能和熱能,在人體中它們被轉換為化學物質。食物在人體運動時被吸收為動能的能量,或其他示例,例如圖5所示。
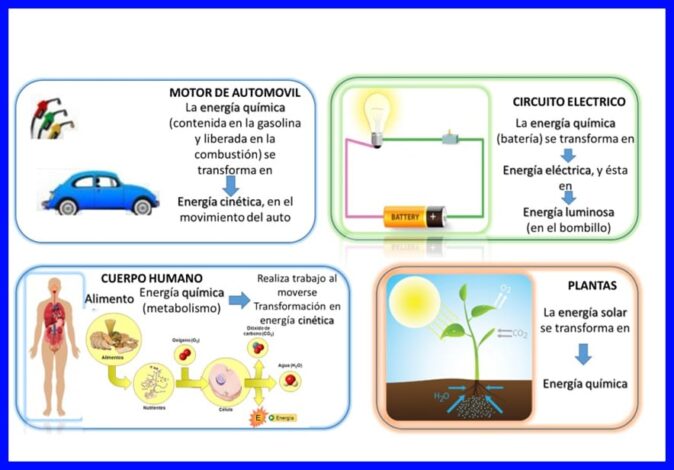
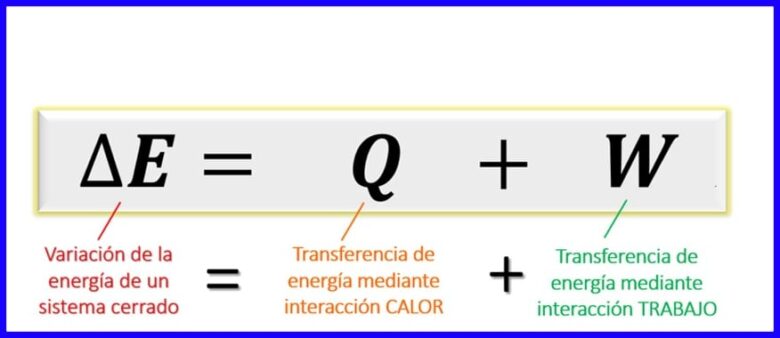
熱力學第一定律的方程式:
熱力學原理中的第一定律方程表示在給定過程中不同類型的能量之間必須存在的平衡。 由於在封閉系統[1]中,只能通過熱傳遞或通過所做的功(由系統或在系統上)進行能量交換,因此可以確定係統的能量變化等於能量的總和。能量通過熱量和功進行傳遞。 參見圖6。
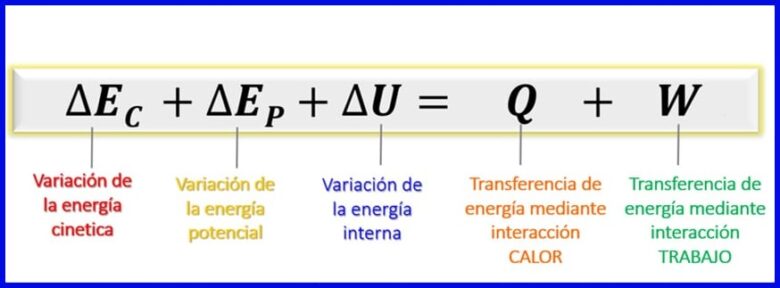
考慮到在此能量平衡中考慮的能量是動能,勢能和內部能量[1],封閉系統的能量平衡仍然如圖7所示。
- (Ec) 動能 由於身體的運動;
- (Ep) 勢能 由於物體在重力場中的位置;
- (U) 內能 , 由於人體內部分子的動能和勢能的微觀貢獻。
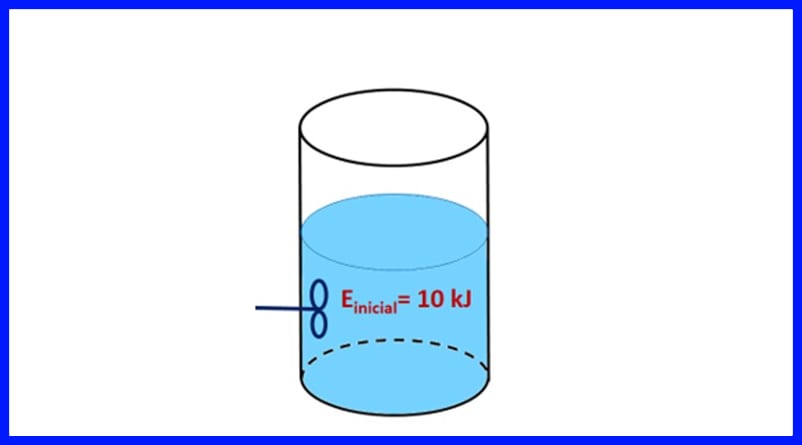
練習1
密封的容器中裝有一種物質,其初始能量為10 kJ。 用做500焦耳工作的螺旋槳攪拌該物質,同時一個熱源將20 kJ的熱量傳遞給該物質。 此外,在此過程中,3kJ的熱量釋放到了空氣中。 確定物質的最終能量。 參見圖8。
解決方案:
在圖9中,您可以看到由熱源增加的熱量,由於它增加了物質的能量,因此被認為是“正”的熱量,釋放到空氣中的熱量則是負的,因為它減少了物質的能量,並且推進器的工作增加了能量,這是一個積極的信號。
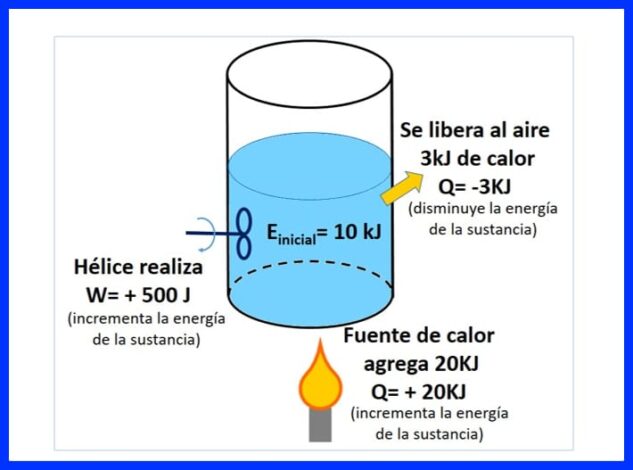
在圖10中,根據熱力學第一定律給出了能量平衡,並獲得了物質的最終能量。

熱力學第二定律
關於熱力學第二定律,有幾種說法:普朗克-開爾文,克勞修斯,卡諾特的陳述。 它們每個都顯示了第二定律的不同方面。 通常,熱力學第二定律假定:
- 熱力學過程的方向,是物理現象的不可逆轉。
- 熱機的效率。
- 輸入屬性“熵”。
熱力學過程的方向:
本質上,能量自發地從最高能量狀態流動或轉移到最低能量狀態。 熱量從熱的物體流到冷的物體,而不是相反。 參見圖11。

效率或熱性能:
根據熱力學第一定律,能量既不會產生也不會破壞,但可以轉化或轉移。 但是,在所有能量轉移或轉化中,一定數量的能量對工作沒有用。 隨著能量的轉移或轉化,一部分初始能量會以熱能的形式釋放出來:能量退化,質量下降。
在任何能量轉換中,獲得的能量總是小於提供的能量。 熱效率是指從熱源轉換成功的熱量,即獲得的有用能量與轉換中提供的能量之間的比率。 見圖12。

熱機或熱機:
熱力機器是一種將熱量部分轉換為功或機械能的設備,為此,它需要一個在高溫下提供熱量的熱源。
在熱力機械中,使用諸如水蒸氣,空氣或燃料的物質。 物質以周期性方式經歷一系列熱力學轉變,因此機器可以連續運行。
練習2
貨車的發動機通過燃燒汽油產生燃燒熱。 對於發動機的每個循環,將5 kJ的熱量轉換為1 kJ的機械功。 電動機的效率是多少? 發動機的每個循環釋放多少熱量? 見圖13
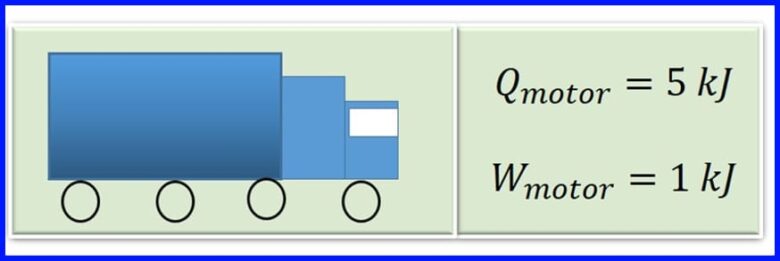
解決方案:

為了確定釋放的熱量,假設熱機中的淨功等於傳遞給系統的淨熱。 見圖14。

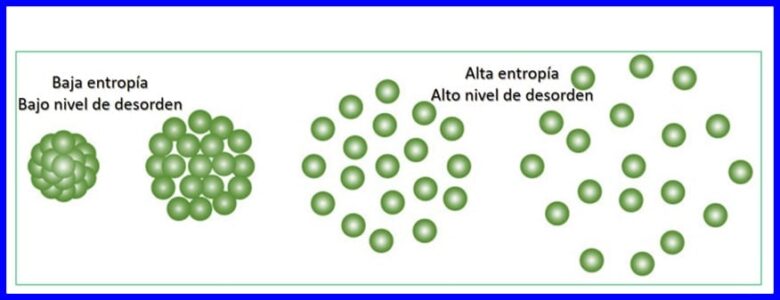
熵:
熵是系統中隨機性或無序性的程度。 熵使得可以量化不能用於產生功的能量部分,即,可以量化熱力學過程的不可逆性。
每次發生的能量轉移都會增加宇宙的熵,並減少可用於做功的可用能量。 任何熱力學過程都將在增加宇宙總熵的方向上進行。 見圖15。
熱力學第三定律
熱力學第三定律或能斯特假設
熱力學第三定律與溫度和冷卻有關。 它指出系統的絕對零熵是一個確定的常數。 見圖16。
絕對零是最低溫度,在該溫度以下不再有更低的度量,它是機體所能達到的最冷的溫度。 絕對零為0 K,等於-273,15ºC。

結論
有四個熱力學原理。 按照零原理,可以確定當兩個或多個物體處於相同溫度時發生熱平衡。
熱力學的第一定律處理過程之間的能量守恆,而熱力學的第二定律處理從最低到最高的熵的方向性,以及將熱轉化為功的熱機的效率或性能。
熱力學的第三定律與溫度和冷卻有關,它指出系統在絕對為零時的熵是一個確定的常數。