Термодинамични принципи
За да разберете по лесен начин широкия и сложен свят на термодинамиката, препоръчително е да преминете стъпка по стъпка, като започнете с преглед на основните термини, въведение в термодинамичните принципи и след това изучете по-задълбочено термодинамичните закони, как те се изразяват математически.и неговите приложения.
С четирите закона на термодинамиката (нулев закон, първи закон, втори закон и трети закон) е описано как работят трансферите и трансформациите на енергия между различните системи; като основа за разбиране на много физикохимични явления в природата.
Преглед на основните понятия
Каним ви да видите статията ТЕРМОДИНАМИКА, какво е тя и нейните приложения

Можете да допълвате тази информация със статията Силата на закона на Уат (приложения - упражнения) Засега СЛЕДВАМЕ ...
Форми на енергия
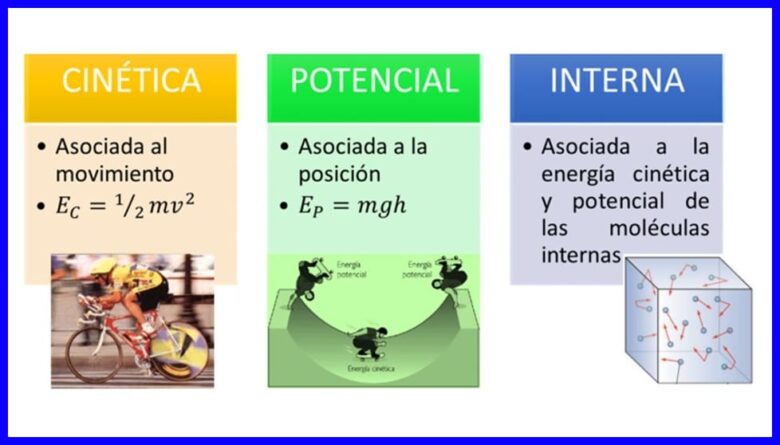
Енергията, свойството на телата да се трансформират, като модифицират своето положение или състояние, се среща в много форми, като кинетична енергия, потенциална енергия и вътрешна енергия на телата. Вижте фигура 1.
Работа
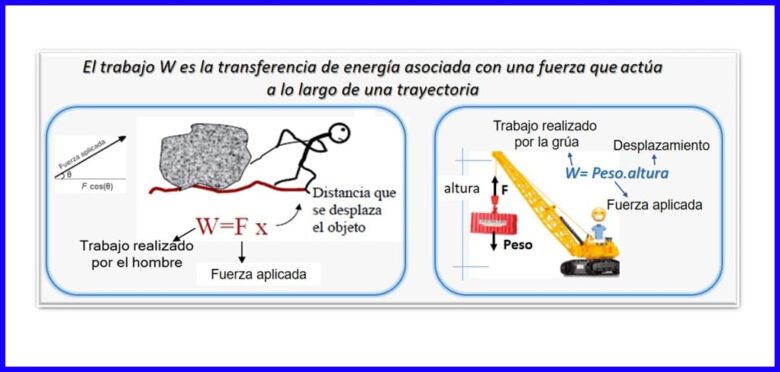
Той е продукт на сила и изместване, измерени в една и съща посока. За изчисляване на работата се използва компонентът на силата, който е успореден на изместването на обекта. Работата се измерва в Nm, Joule (J), ft.lb-f или BTU. Вижте фигура 2.
Топлина (Q)
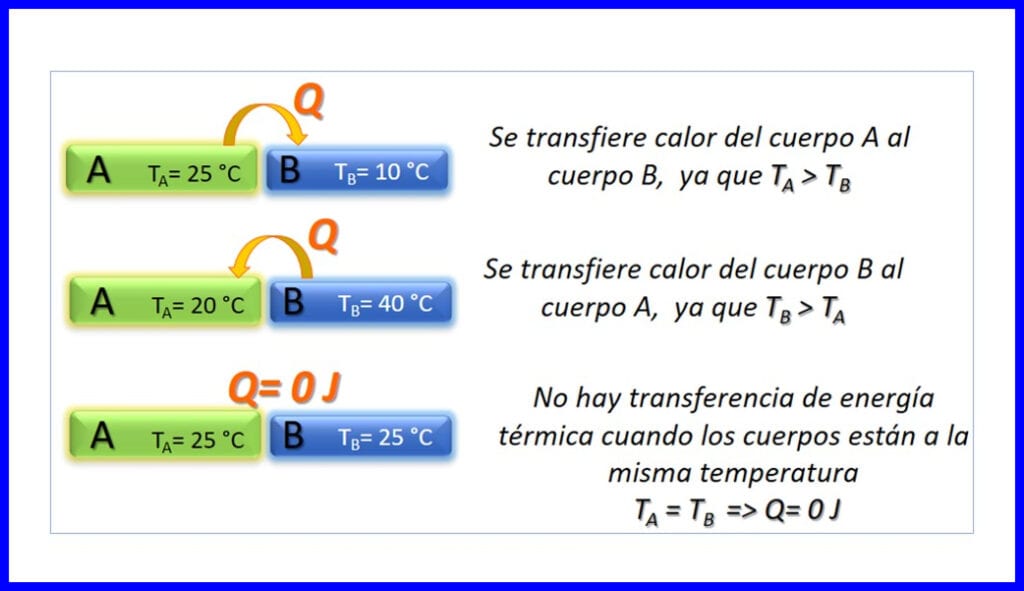
Пренос на топлинна енергия между две тела, които са с различни температури, и това се случва само в смисъл, че температурата намалява. Топлината се измерва в джаул, BTU, фунт фута или в калории. Вижте фигура 3.
Термодинамични принципи
Нулев закон - нулев принцип
Нулевият закон на термодинамиката гласи, че ако два обекта, A и B, са в топлинно равновесие помежду си и обект A е в равновесие с трети обект C, тогава обект B е в топлинно равновесие с обект C. Настъпва термичното равновесие когато две или повече тела са с еднаква температура. Вижте фигура 4.
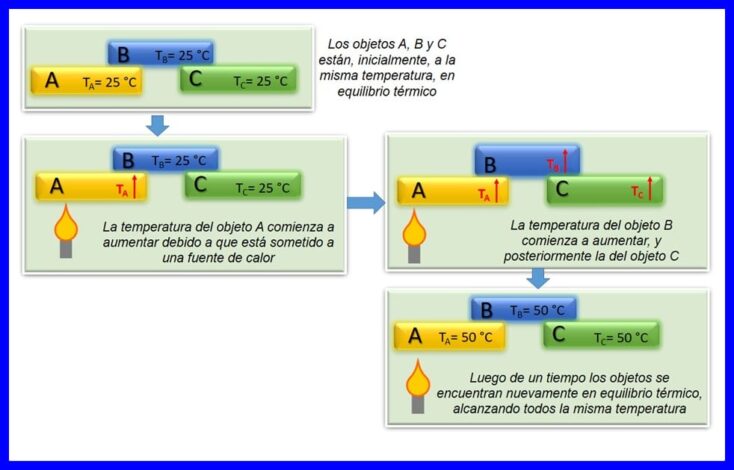
Този закон се счита за основен закон на термодинамиката. Той беше постулиран като „Нулев закон“ през 1935 г., тъй като беше постулиран след създаването на първия и втория закон на термодинамиката.
1-ви закон на термодинамиката (Принцип на запазване на енергията)
Изявление на първия закон на термодинамиката:
Първият закон на термодинамиката, известен още като принцип за запазване на енергията, гласи, че енергията не се създава или унищожава, тя се трансформира само в друг вид енергия или се прехвърля от един обект в друг. По този начин общото количество енергия във Вселената не се променя.
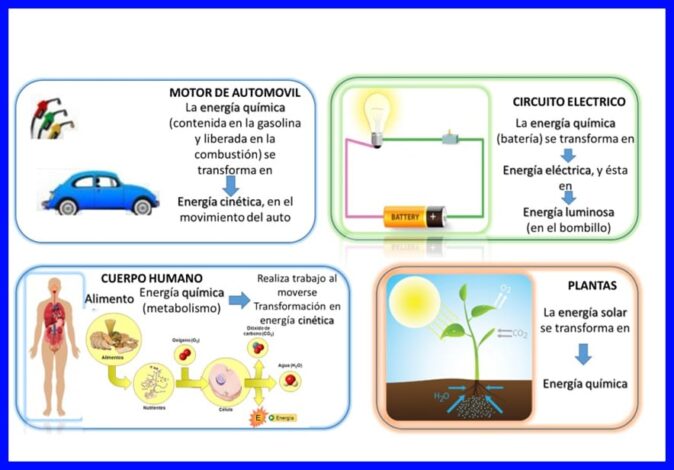
Първият закон се изпълнява във „всичко”, енергията се прехвърля и трансформира непрекъснато, например в някои електрически устройства, като миксери и смесители, електрическата енергия се трансформира в механична и топлинна енергия, в човешкото тяло те се трансформират химически енергия на храната, която се поглъща в кинетична енергия, когато тялото е в движение, или други примери като тези, показани на фигура 5.
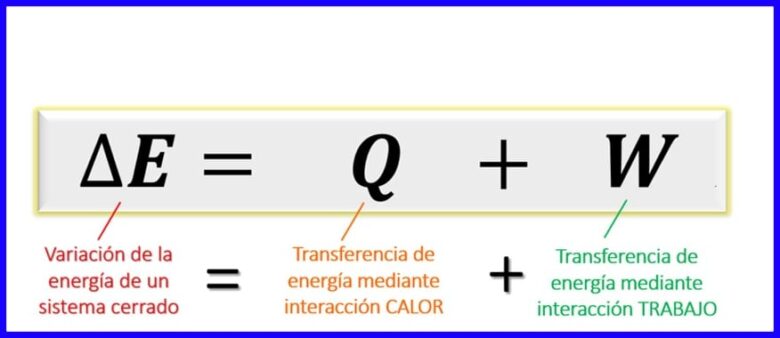
Уравнение на първия закон на термодинамиката:
Уравнението на първия закон в рамките на термодинамичните принципи изразява баланса, който трябва да съществува между различните видове енергия в даден процес. Тъй като в затворени системи [1] енергийният обмен може да бъде даден само чрез предаване на топлина или чрез извършената работа (от или върху системата), се установява, че енергийните вариации на системата са равни на сумата от енергийни трансфери чрез топлина и чрез работа. Вижте фигура 6.
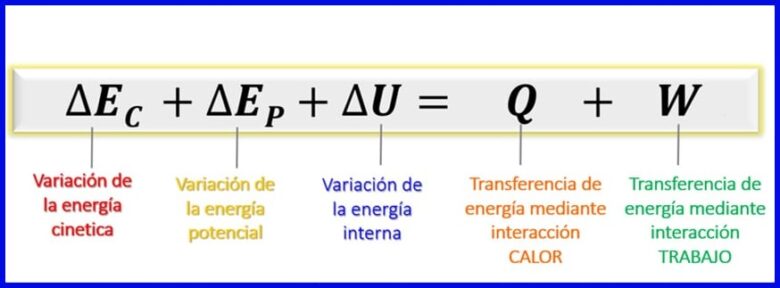
Като се има предвид, че енергиите, разглеждани в този енергиен баланс, са кинетична енергия, потенциална енергия и вътрешна енергия [1], енергийният баланс за затворените системи остава, както е показано на фигура 7.
- (Ек) Кинетична енергия , поради движението на тяло;
- (Еп) Потенциална енергия, поради положението на тялото в гравитационно поле;
- (ИЛИ) Вътрешна енергия , поради микроскопичния принос на кинетичната и потенциалната енергия на вътрешните молекули на тялото.
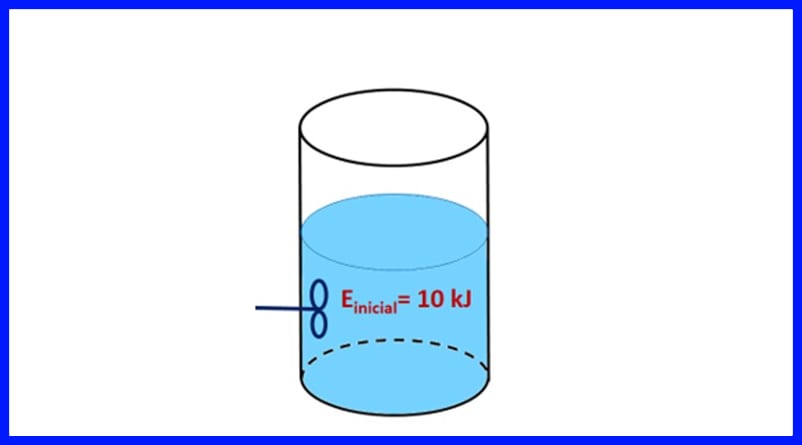
Упражнение 1.
Запечатан контейнер съдържа вещество с начална енергия 10 kJ. Веществото се разбърква с витло, което работи 500 J, докато източник на топлина предава 20 kJ топлина към веществото. В допълнение, 3kJ топлина се отделя във въздуха по време на процеса. Определете крайната енергия на веществото. Вижте фигура 8.
Решение:
На фигура 9 можете да видите топлината, добавена от източника на топлина, която се счита за "положителна", тъй като увеличава енергията на веществото, топлината, която се отделя във въздуха, отрицателна, тъй като намалява енергията на веществото и работата на витлото, което увеличава енергията приема положителен знак.
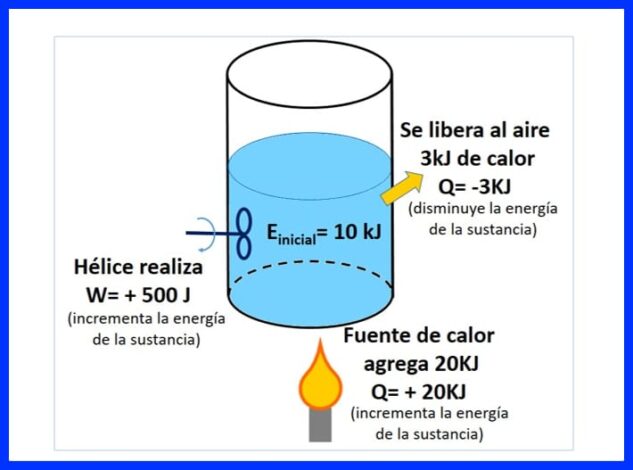
На фигура 10 е представен енергийният баланс, съгласно първия закон на термодинамиката и се получава крайната енергия на веществото.

Втори закон на термодинамиката
Има няколко твърдения за втория закон на термодинамиката: Изказване на Планк-Келвин, Клаузиус, Карно. Всеки от тях показва различен аспект на втория закон. Като цяло вторият закон на термодинамиката постулира:
- Посоката на термодинамичните процеси, необратимост на физическите явления.
- Ефективността на термичните машини.
- Въведете свойството "ентропия".
Посока на термодинамичните процеси:
Спонтанно в природата енергията протича или се прехвърля от най-високо енергийното състояние в най-ниското енергийно състояние. Топлината преминава от горещи тела към студени тела, а не обратното. Вижте фигура 11.

Ефективност или топлинна ефективност:
Според първия закон на термодинамиката енергията нито се създава, нито се разрушава, но може да се трансформира или прехвърли. Но при всички енергийни трансфери или трансформации количество от него не е полезно за вършене на работа. Когато енергията се прехвърля или трансформира, част от първоначалната енергия се освобождава като топлинна енергия: енергията се разгражда, губи качество.
При всяка енергийна трансформация количеството получена енергия винаги е по-малко от доставената енергия. Термичната ефективност е количеството топлина от източника, което се превръща в работа, съотношението между получената полезна енергия и енергията, доставена при трансформация. Вижте фигура 12.

Термична машина или топлинна машина:
Термичната машина е устройство, което частично преобразува топлината в работна или механична енергия, за това тя изисква източник, който доставя топлина при висока температура.
В термичните машини се използва вещество като водна пара, въздух или гориво. Веществото претърпява серия от термодинамични трансформации по цикличен начин, така че машината може да работи непрекъснато.
Упражнение 2.
Двигателят на товарен автомобил произвежда топлина при горене чрез изгаряне на бензин. За всеки цикъл на двигателя топлината от 5 kJ се превръща в 1kJ механична работа. Каква е ефективността на двигателя? Колко топлина се отделя за всеки цикъл на двигателя? Вижте фигура 13
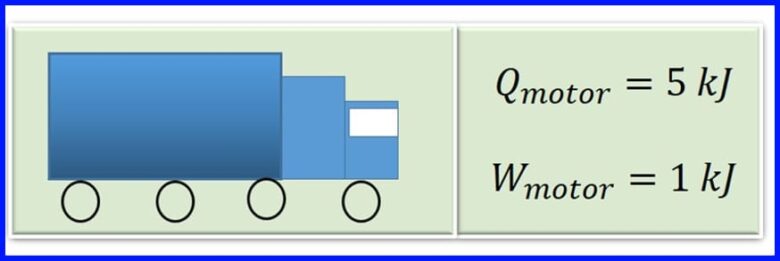
Решение:

За да се определи отделената топлина, се приема, че в термичните машини нетната работа е равна на нетния топлопренос в системата. Вижте фигура 14.

Ентропия:
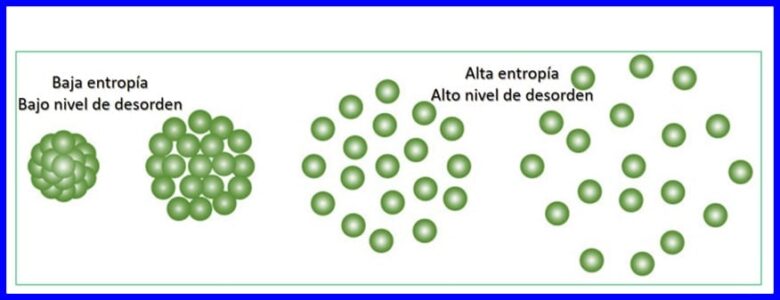
Ентропията е степента на случайност или разстройство в системата. Ентропията дава възможност да се определи количествено частта от енергията, която не може да се използва за произвеждане на работа, тоест дава възможност да се определи количествено необратимостта на термодинамичния процес.
Всеки трансфер на енергия, който се случва, увеличава ентропията на Вселената и намалява количеството използваема енергия, налична за работа. Всеки термодинамичен процес ще продължи в посока, която увеличава общата ентропия на Вселената. Вижте фигура 15.
3-ти закон на термодинамиката
Трети закон на термодинамиката или Nerst Postulate
Третият закон на термодинамиката е свързан с температурата и охлаждането. Той гласи, че ентропията на система при абсолютна нула е определена константа. Вижте фигура 16.
Абсолютната нула е най-ниската температура, под която вече няма по-ниска мярка, тя е най-студената, която може да бъде тялото. Абсолютната нула е 0 K, еквивалентно на -273,15 ºC.

Заключение
Има четири термодинамични принципа. При нулевия принцип се установява, че топлинното равновесие настъпва, когато две или повече тела са с еднаква температура.
Първият закон на термодинамиката се занимава със запазването на енергията между процесите, докато вторият закон на термодинамиката се занимава с насочеността от най-ниската към най-високата ентропия и ефективността или производителността на топлинните машини, които превръщат топлината в работа.
Третият закон на термодинамиката е свързан с температурата и охлаждането, той гласи, че ентропията на система при абсолютна нула е определена константа.