Termodinamiese beginsels
Om die wye en ingewikkelde wêreld van termodinamika op 'n maklike manier te verstaan, word aanbeveel om stap vir stap te begin met 'n oorsig van basiese terme, 'n inleiding tot termodinamiese beginsels, en dan die termodinamiese wette in meer diepte te bestudeer word wiskundig uitgedruk en die toepassings daarvan.
Met die vier wette van termodinamika (zero wet, eerste wet, tweede wet en derde wet) word beskryf hoe die oordrag en transformasies van energie tussen verskillende stelsels werk; synde die basis vir die begrip van baie fisikochemiese verskynsels van die natuur.
Hersiening van basiese konsepte
Ons nooi u uit om die artikel te sien TERMODINAMIKA, wat dit is en die toepassings daarvan

U kan hierdie inligting aanvul met die artikel Die krag van Watt se wet (toepassings - oefeninge) Vir die tyd wat ONS VOLG ...
Vorme van energie
Energie, die eiendom van liggame om hulself te transformeer deur hul situasie of toestand te verander, kom in baie vorme voor, soos kinetiese energie, potensiële energie en interne energie van liggame. Sien figuur 1.
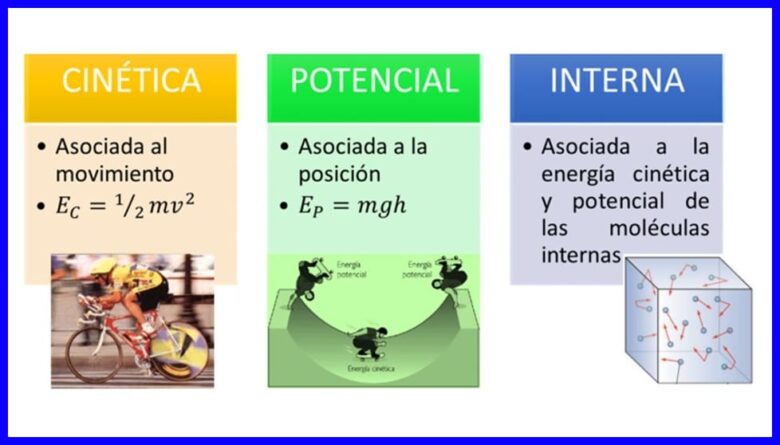
Werk
Dit is die produk van 'n krag en verplasing, albei in dieselfde rigting gemeet. Om die werk te bereken, word die komponent van die krag wat parallel is met die verplasing van die voorwerp, gebruik. Werk word gemeet in Nm, Joule (J), ft.lb-f of BTU. Sien figuur 2.
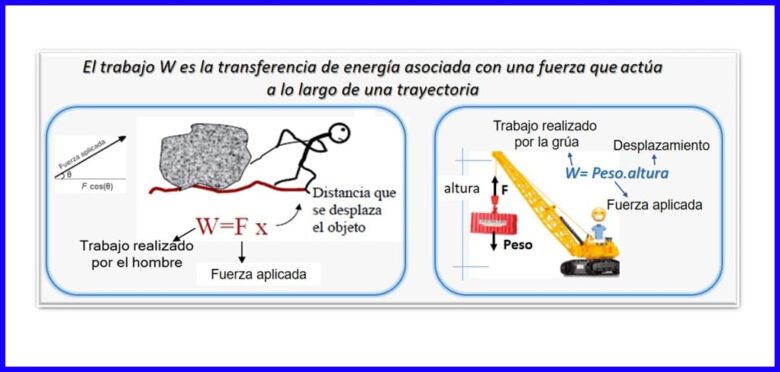
Verhit (Q)
Oordrag van termiese energie tussen twee liggame wat by verskillende temperature is, en dit vind slegs plaas in die sin dat die temperatuur daal. Hitte word gemeet in Joule, BTU, pondvoet of in kalorieë. Sien figuur 3.
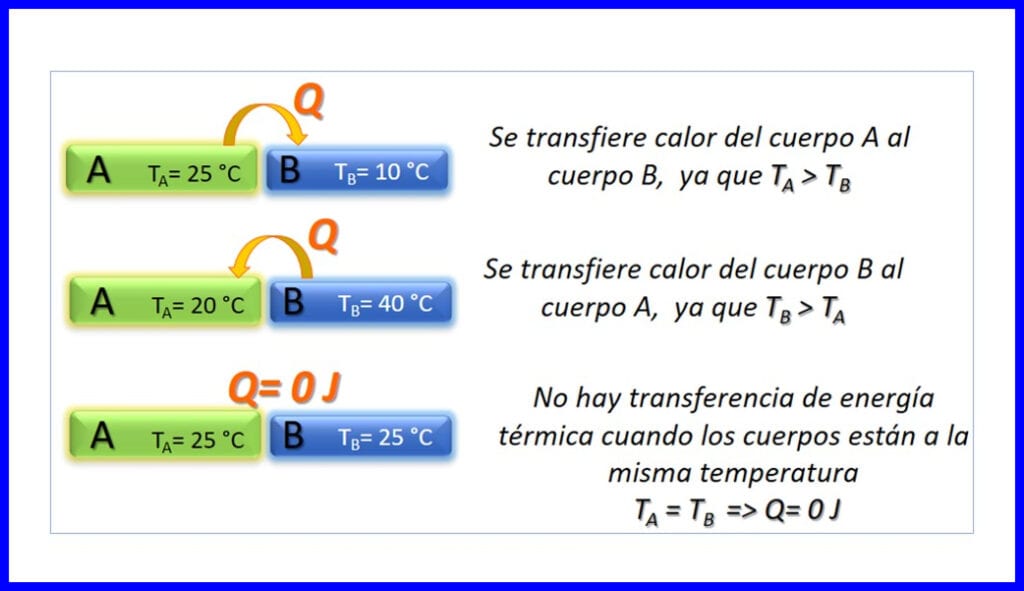
Termodinamiese beginsels
Nulreg - Nulbeginsel
Die zero wet van termodinamika stel dat as twee voorwerpe, A en B, in termiese ewewig met mekaar is, en voorwerp A in ewewig is met 'n derde voorwerp C, dan is voorwerp B in termiese ewewig met voorwerp C. Die termiese ewewig vind plaas wanneer twee of meer liggame op dieselfde temperatuur is. Sien figuur 4.
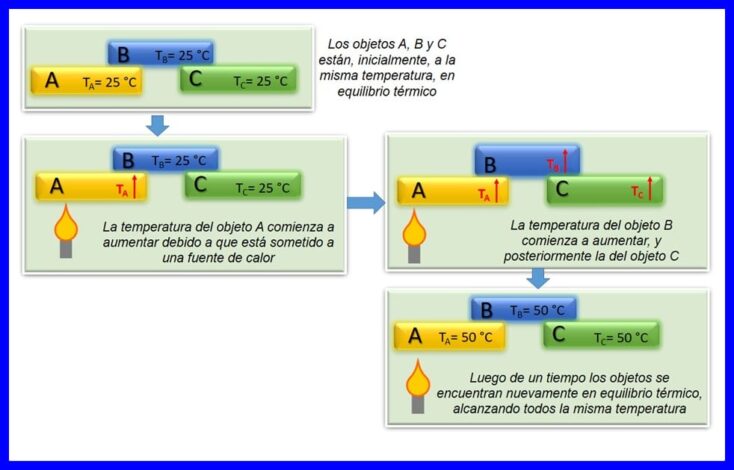
Hierdie wet word beskou as 'n basiese wet van termodinamika. Dit is in 1935 as 'Zero Law' gepostuleer, aangesien dit gepostuleer is nadat die eerste en tweede wette van die termodinamika gemaak is.
1ste wet op termodinamika (beginsel van behoud van energie)
Verklaring van die eerste wet van termodinamika:
Die eerste wet van termodinamika, ook bekend as die beginsel van die behoud van energie, sê dat energie nie geskep of vernietig word nie, maar net in 'n ander soort energie getransformeer word, of dat dit van een voorwerp na 'n ander oorgedra word. Dus verander die totale hoeveelheid energie in die heelal nie.
Die eerste wet word in "alles" vervul, energie word deurlopend oorgedra en getransformeer, byvoorbeeld in sommige elektriese toestelle, soos mengers en mengers, word elektriese energie omgeskakel in meganiese en termiese energie, in die menslike liggaam word dit die chemiese stof energie van voedsel wat in kinetiese energie ingeneem word as die liggaam in beweging is, of ander voorbeelde soos in figuur 5 getoon.
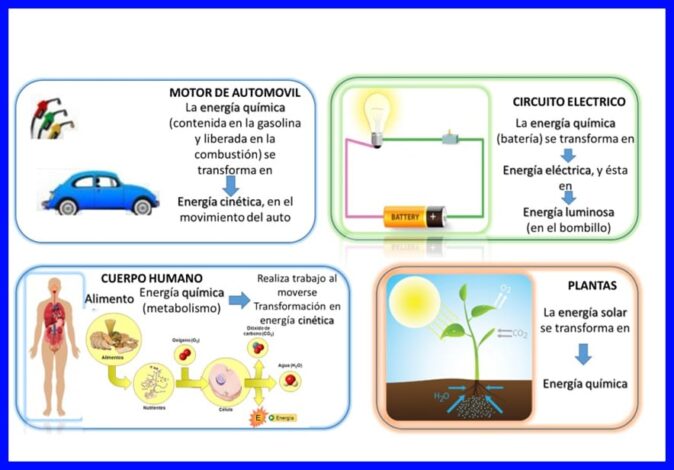
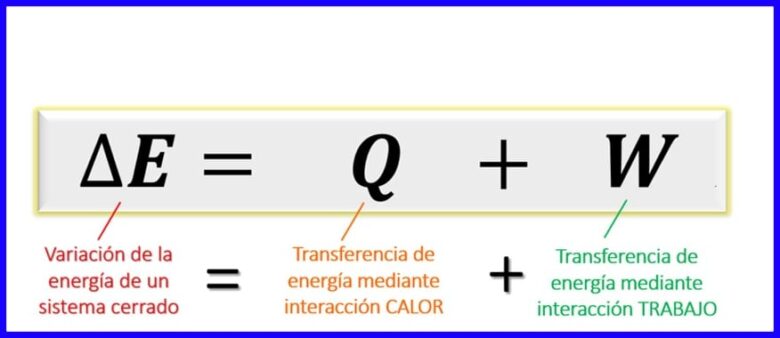
Vergelyking van die eerste wet van termodinamika:
Die vergelyking van die eerste wet binne die termodinamiese beginsels druk die balans uit wat tussen die verskillende soorte energie in 'n gegewe proses moet bestaan. Aangesien energie-uitruilings in geslote stelsels [1] slegs deur die oordrag van hitte of deur die werk (deur of aan die stelsel) verrig kan word, word vasgestel dat die energie-variasie van 'n stelsel gelyk is aan die som van energie-oordrag deur hitte en deur werk. Sien figuur 6.
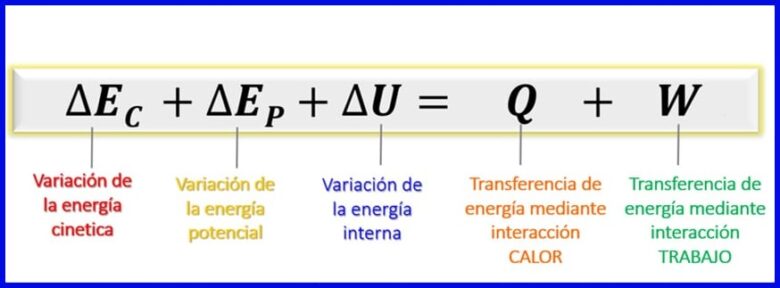
Aangesien die energieë wat in hierdie energiebalans oorweeg word, kinetiese energie, potensiële energie en interne energie is [1], bly die energiebalans vir geslote stelsels soos getoon in figuur 7.
- (ec) Kinetiese energie , as gevolg van die beweging van 'n liggaam;
- (ep) Potensiële energie, as gevolg van die posisie van 'n liggaam in 'n swaartekragveld;
- (OR) Interne energie, as gevolg van die mikroskopiese bydraes van die kinetiese en potensiële energie van die interne molekules van 'n liggaam.
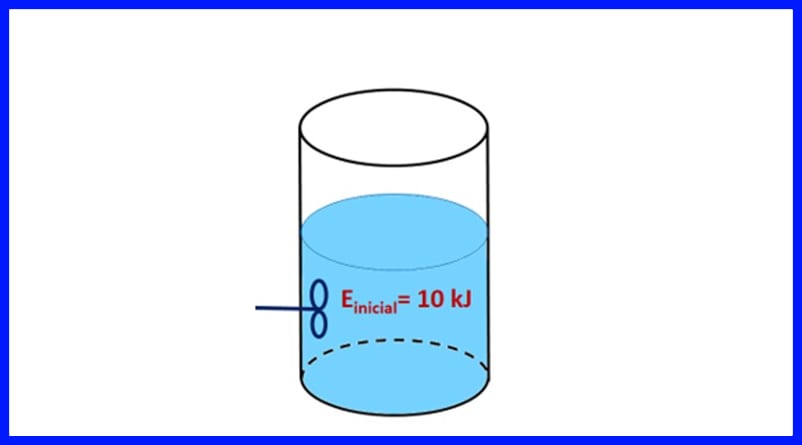
Oefening 1.
'N Verseëlde houer bevat 'n stof met 'n aanvanklike energie van 10 kJ. Die stof word geroer met 'n skroef wat 500 J werk, terwyl 'n hittebron 20 kJ hitte na die stof oordra. Daarbenewens word 3kJ hitte tydens die proses in die lug vrygestel. Bepaal die finale energie van die stof. Sien figuur 8.
oplossing:
In figuur 9 kan u die hitte sien wat deur die hittebron toegevoeg word, wat as 'positief' beskou word, aangesien dit die energie van die stof verhoog, die hitte wat in die lug vrygestel word, negatief omdat dit die energie van die stof verlaag en die werk van die skroef, wat die energie verhoog het, het 'n positiewe teken gekry.
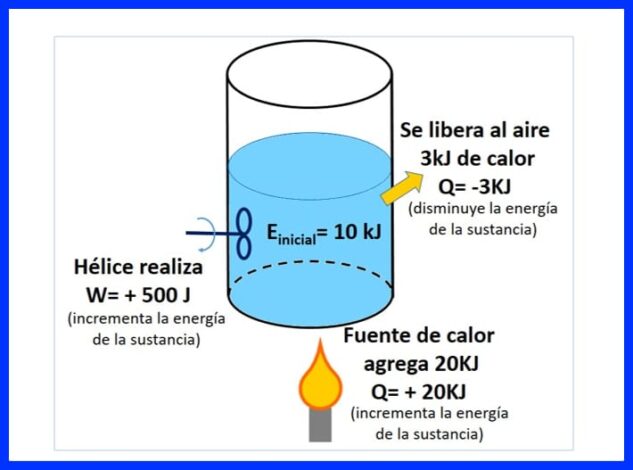
In figuur 10 word die energiebalans aangebied volgens die eerste wet van termodinamika en word die finale energie van die stof verkry.

Tweede wet van termodinamika
Daar is verskillende stellings van die tweede wet van termodinamika: Stelling van Planck-Kelvin, Clausius, Carnot. Elkeen toon 'n ander aspek van die tweede wet. Oor die algemeen postuleer die tweede wet van termodinamika:
- Die rigting van termodinamiese prosesse, onomkeerbaarheid van fisiese verskynsels.
- Die doeltreffendheid van termiese masjiene.
- Voer die eiendom "entropie" in.
Rigting van termodinamiese prosesse:
Spontaan in die natuur vloei of word energie van die hoogste energietoestand na die laagste energietoestand oorgedra. Hitte vloei van warm liggame na koue liggame en nie andersom nie. Sien figuur 11.

Doeltreffendheid of termiese prestasie:
Volgens die eerste wet van termodinamika word energie nie geskep of vernietig nie, maar kan dit getransformeer of oorgedra word. Maar in alle energie-oordragte of -transformasies is 'n hoeveelheid daarvan nie nuttig om werk te doen nie. Soos energie oorgedra of getransformeer word, word 'n deel van die aanvanklike energie vrygestel as termiese energie: energie verswak, verloor kwaliteit.
In enige energietransformasie is die hoeveelheid energie wat verkry word, altyd minder as die energie wat verskaf word. Termiese doeltreffendheid is die hoeveelheid hitte van die bron wat in werk omgeskakel word, die verhouding tussen die nuttige energie verkry en die energie wat tydens 'n transformasie voorsien word. Sien figuur 12.

Termiese masjien of hitte masjien:
Die termiese masjien is 'n apparaat wat hitte gedeeltelik in werk of meganiese energie omskakel, hiervoor is 'n bron nodig wat hitte by hoë temperatuur voorsien.
In termiese masjiene word 'n stof soos waterdamp, lug of brandstof gebruik. Die stof ondergaan 'n reeks termodinamiese transformasies op 'n sikliese manier, sodat die masjien deurlopend kan werk.
Oefening 2.
Die enjin van 'n vragmotor produseer hitte in die verbranding deur petrol te verbrand. Vir elke enjinsiklus word die hitte van 5 kJ omgeskakel in 1kJ meganiese werk. Wat is die doeltreffendheid van die motor? Hoeveel hitte word vrygestel vir elke siklus van die enjin? Sien figuur 13
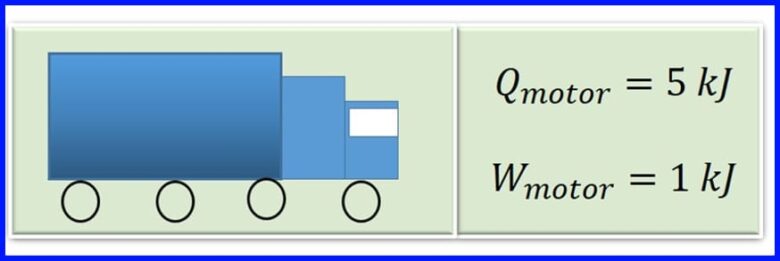
oplossing:

Om die vrygestelde hitte te bepaal, word aanvaar dat die netto werk in termiese masjiene gelyk is aan die netto hitte-oordrag na die stelsel. Sien figuur 14.

Entropie:
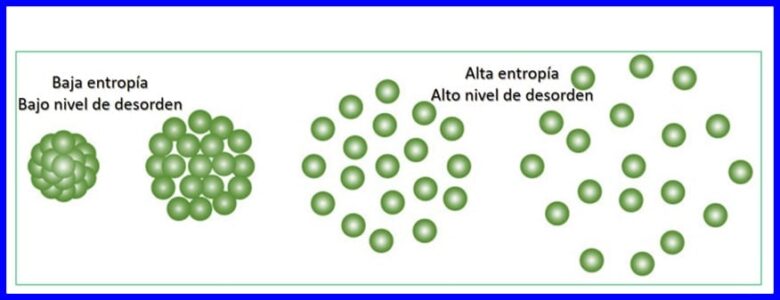
Entropie is die mate van ewekansigheid of wanorde in 'n stelsel. Entropie laat die deel van energie toe wat nie gebruik kan word om werk te produseer nie, dit wil sê die onomkeerbaarheid van 'n termodinamiese proses kan kwantifiseer.
Elke energie-oordrag wat plaasvind, verhoog die entropie van die heelal en verminder die hoeveelheid bruikbare energie wat beskikbaar is om werk te verrig. Enige termodinamiese proses sal in 'n rigting beweeg wat die totale entropie van die heelal verhoog. Sien figuur 15.
3de wet van termodinamika
Derde wet van termodinamika of Nerst Postulate
Die derde wet van termodinamika hou verband met temperatuur en verkoeling. Dit stel dat die entropie van 'n stelsel by absolute nul 'n definitiewe konstante is. Sien figuur 16.
Absolute nul is die laagste temperatuur waaronder daar nie meer 'n laer maat is nie, dit is die koudste wat 'n liggaam kan wees. Die absolute nul is 0 K, gelykstaande aan -273,15 ºC.

Gevolgtrekking
Daar is vier termodinamiese beginsels. In die zero-beginsel word vasgestel dat termiese ewewig voorkom wanneer twee of meer liggame op dieselfde temperatuur is.
Die eerste wet van termodinamika handel oor die behoud van energie tussen prosesse, terwyl die tweede wet van termodinamika handel oor die rigting van die laagste tot die hoogste entropie, en die doeltreffendheid of werkverrigting van hitte-enjins wat hitte in werk omskakel.
Die derde wet van termodinamika hou verband met temperatuur en verkoeling, dit stel dat die entropie van 'n stelsel by absolute nul 'n definitiewe konstante is.