ຫຼັກການກ່ຽວກັບຄວາມຮ້ອນ
ເພື່ອເຂົ້າໃຈ, ໃນວິທີທີ່ງ່າຍ, ໂລກກວ້າງແລະສະລັບສັບຊ້ອນຂອງ Thermodynamics, ແນະ ນຳ ໃຫ້ກ້າວໄປເທື່ອລະບາດກ້າວໂດຍເລີ່ມຕົ້ນດ້ວຍການທົບທວນຄືນກ່ຽວກັບເງື່ອນໄຂພື້ນຖານ, ການແນະ ນຳ ກ່ຽວກັບຫຼັກການກ່ຽວກັບ thermodynamic, ແລະຈາກນັ້ນສຶກສາຄວາມເລິກຂອງກົດ ໝາຍ ກ່ຽວກັບ thermodynamic, ວິທີ ແລະການສະ ໝັກ ຂອງມັນ.
ດ້ວຍ XNUMX ກົດ ໝາຍ ກ່ຽວກັບເຄື່ອງວັດແທກຄວາມຮ້ອນ (ກົດ ໝາຍ ສູນ, ກົດ ໝາຍ ທຳ ອິດ, ກົດ ໝາຍ ທີສອງແລະກົດ ໝາຍ ທີສາມ), ມັນໄດ້ຖືກອະທິບາຍກ່ຽວກັບວິທີການໂອນຍ້າຍແລະການປ່ຽນພະລັງງານລະຫວ່າງລະບົບຕ່າງໆ; ເປັນພື້ນຖານໃນການເຂົ້າໃຈປະກົດການທາງກາຍ - ສານເຄມີຫຼາຍຢ່າງຂອງ ທຳ ມະຊາດ.
ການທົບທວນຄືນແນວຄວາມຄິດພື້ນຖານ
ພວກເຮົາເຊີນທ່ານເຂົ້າເບິ່ງບົດຄວາມ THERMODYNAMICS, ມັນແມ່ນຫຍັງແລະມີການ ນຳ ໃຊ້ແນວໃດ

ທ່ານສາມາດປະກອບຂໍ້ມູນນີ້ໃສ່ບົດຄວາມ ພະລັງງານຂອງກົດ ໝາຍ Watt (ການ ນຳ ໃຊ້ - ອອກ ກຳ ລັງກາຍ) ສໍາລັບໃນປັດຈຸບັນ ພວກເຮົາປະຕິບັດຕາມ ...
ຮູບແບບຂອງພະລັງງານ
ພະລັງງານ, ຊັບສົມບັດຂອງຮ່າງກາຍໃນການຫັນປ່ຽນຕົວເອງໂດຍການດັດແປງສະຖານະການຫຼືສະຖານະພາບຂອງມັນ, ມີຫລາຍຮູບແບບ, ເຊັ່ນວ່າ ພະລັງງານ kinetic, ພະລັງງານທີ່ມີທ່າແຮງແລະພະລັງງານພາຍໃນຂອງຮ່າງກາຍ. ເບິ່ງຮູບ 1.
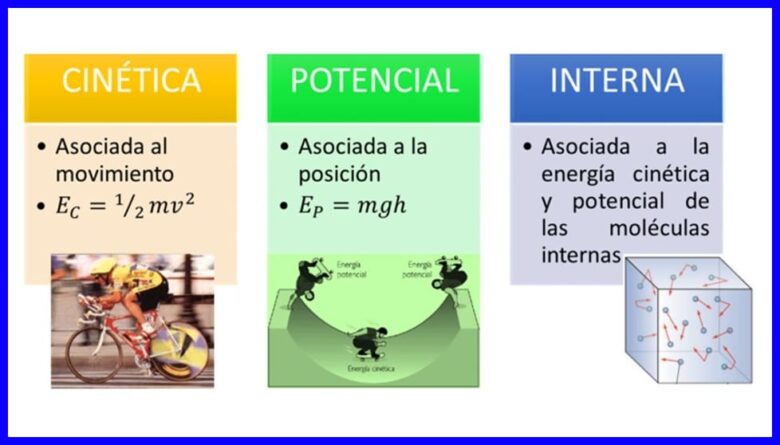
ເຮັດວຽກ
ມັນແມ່ນຜະລິດຕະພັນຂອງແຮງແລະການຍ້າຍຖິ່ນຖານ, ທັງສອງວັດໃນທິດທາງດຽວກັນ. ເພື່ອຄິດໄລ່ການເຮັດວຽກ, ສ່ວນປະກອບຂອງແຮງທີ່ທຽບເທົ່າກັບການຍ້າຍຖິ່ນຖານຂອງວັດຖຸຖືກໃຊ້. ການເຮັດວຽກແມ່ນວັດແທກໃນ Nm, Joule (J), ft.lb-f, ຫຼື BTU. ເບິ່ງຮູບ 2.
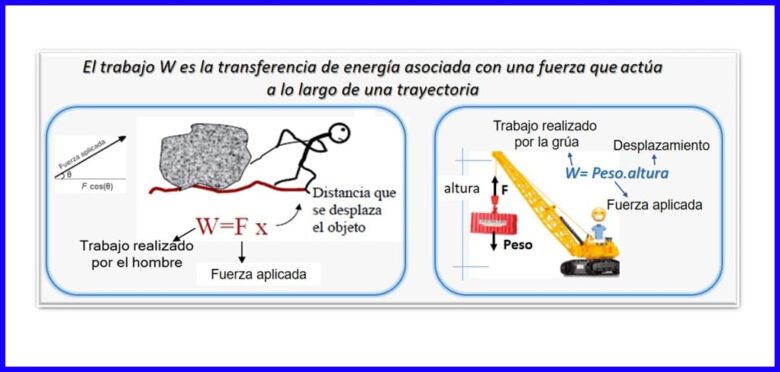
ຄວາມຮ້ອນ (Q)
ການໂອນພະລັງງານຄວາມຮ້ອນລະຫວ່າງສອງອົງການຈັດຕັ້ງທີ່ມີອຸນຫະພູມທີ່ແຕກຕ່າງກັນ, ແລະມັນເກີດຂື້ນພຽງແຕ່ໃນຄວາມ ໝາຍ ທີ່ວ່າອຸນຫະພູມຫຼຸດລົງ. ຄວາມຮ້ອນໄດ້ຖືກວັດແທກໃນ Joule, BTU, ປອນ, ຫຼືໃນພະລັງງານ. ເບິ່ງຮູບທີ 3.
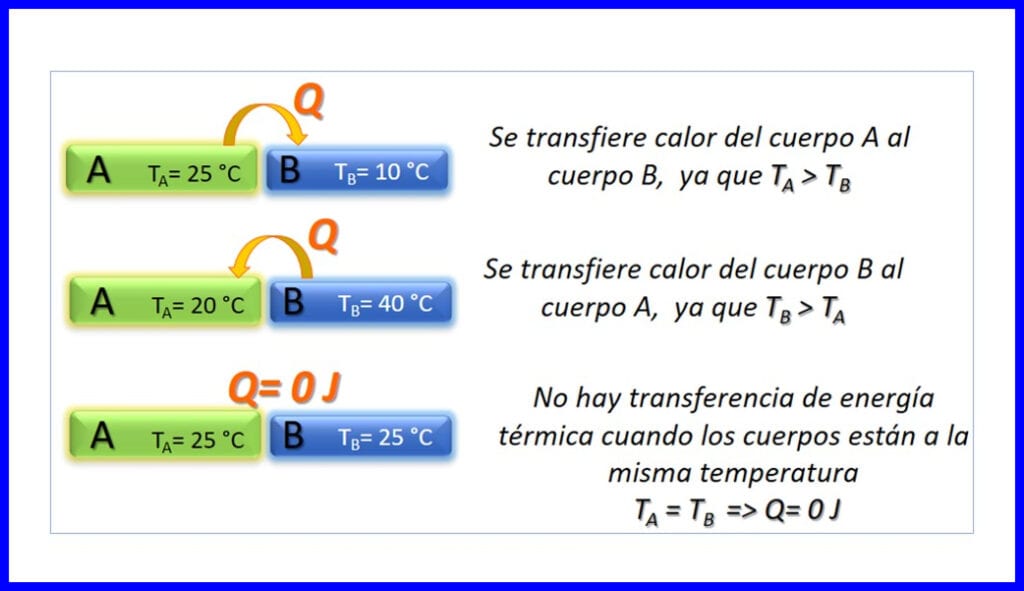
ຫຼັກການກ່ຽວກັບຄວາມຮ້ອນ
ກົດ ໝາຍ ສູນ - ຫຼັກການສູນ
ກົດ ໝາຍ ສູນວັດແທກຄວາມຮ້ອນບອກວ່າຖ້າວັດຖຸສອງຢ່າງ A ແລະ B ຢູ່ໃນຄວາມສົມດຸນລະບາຍຄວາມຮ້ອນກັບກັນແລະວັດຖຸ A ຢູ່ໃນຄວາມສົມດຸນກັບວັດຖຸທີສາມ C, ວັດຖຸ B ແມ່ນຢູ່ໃນຄວາມສົມດຸນຄວາມຮ້ອນກັບວັດຖຸ C. ຄວາມສົມດຸນຄວາມຮ້ອນເກີດຂື້ນ ເມື່ອສອງຫຼືຫຼາຍກວ່າຮ່າງກາຍຢູ່ໃນອຸນຫະພູມດຽວກັນ. ເບິ່ງຮູບທີ 4.
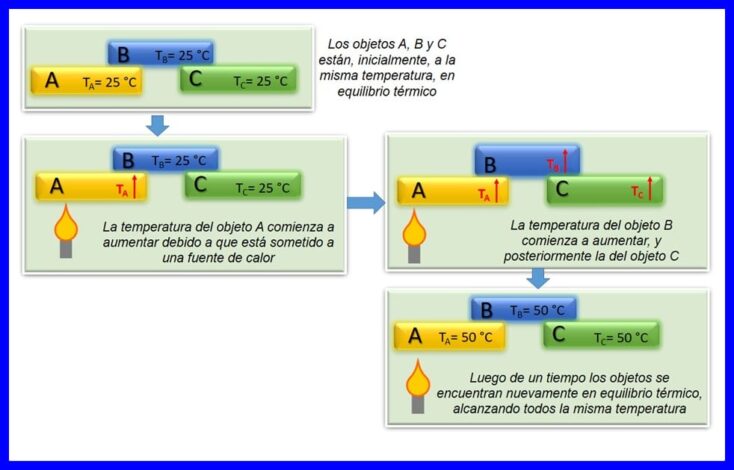
ກົດ ໝາຍ ນີ້ຖືກຖືວ່າເປັນກົດ ໝາຍ ພື້ນຖານຂອງວັດແທກອຸນຫະພູມ. ມັນຖືກສະ ເໜີ ອອກເປັນ "ກົດ ໝາຍ ວ່າດ້ວຍກົດ ໝາຍ", ໃນປີ 1935, ນັບແຕ່ໄດ້ມີການປະກາດໃຊ້ຫຼັງຈາກກົດ ໝາຍ ທຳ ອິດແລະທີສອງກ່ຽວກັບເຄື່ອງວັດແທກອຸນຫະພູມ.
ກົດ ໝາຍ ວ່າດ້ວຍ Thermodynamics ທີ 1 (ຫຼັກການໃນການອະນຸລັກພະລັງງານ)
ຖະແຫຼງການຂອງກົດ ໝາຍ ວ່າດ້ວຍວັດແທກຄວາມຮ້ອນຄັ້ງ ທຳ ອິດ:
ກົດ ໝາຍ ທຳ ອິດຂອງບາຫຼອດ, ເຊິ່ງເອີ້ນກັນວ່າຫຼັກການໃນການອະນຸລັກພະລັງງານ, ກ່າວວ່າພະລັງງານບໍ່ໄດ້ຖືກສ້າງຂື້ນຫລື ທຳ ລາຍ, ມັນພຽງແຕ່ປ່ຽນເປັນພະລັງງານປະເພດອື່ນ, ຫລືມັນຖືກໂອນຈາກວັດຖຸ ໜຶ່ງ ໄປອີກວັດຖຸ ໜຶ່ງ. ດັ່ງນັ້ນ ຈຳ ນວນພະລັງງານທັງ ໝົດ ໃນຈັກກະວານບໍ່ປ່ຽນແປງ.
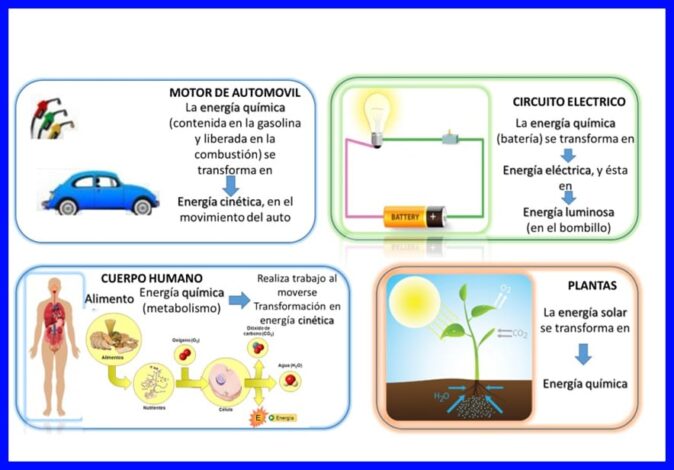
ກົດ ໝາຍ ສະບັບ ທຳ ອິດແມ່ນບັນລຸໃນ“ ທຸກສິ່ງທຸກຢ່າງ”, ພະລັງງານຖືກຍົກຍ້າຍແລະຫັນປ່ຽນຢ່າງຕໍ່ເນື່ອງ, ເຊັ່ນວ່າໃນອຸປະກອນໄຟຟ້າບາງຊະນິດ, ເຊັ່ນເຄື່ອງປະສົມແລະເຄື່ອງປັ່ນ, ພະລັງງານໄຟຟ້າໄດ້ຖືກປ່ຽນເປັນພະລັງງານກົນຈັກແລະພະລັງຄວາມຮ້ອນ, ໃນຮ່າງກາຍຂອງມະນຸດພວກມັນຫັນເປັນສານເຄມີ ພະລັງງານຂອງອາຫານທີ່ກິນເຂົ້າໄປໃນພະລັງງານທາງດ້ານການເມືອງເມື່ອຮ່າງກາຍເຄື່ອນໄຫວ, ຫຼືຕົວຢ່າງອື່ນໆເຊັ່ນຕົວຢ່າງທີ່ສະແດງໃນຮູບ 5.
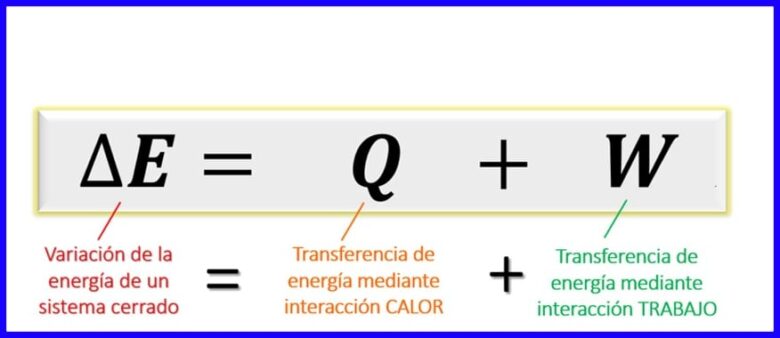
ສົມຜົນຂອງກົດ ໝາຍ ວ່າດ້ວຍວັດຖຸດິບ ທຳ ອິດ:
ສົມຜົນຂອງກົດ ໝາຍ ສະບັບ ທຳ ອິດພາຍໃນຫຼັກການຂອງອຸນຫະພູມສະແດງຄວາມສົມດຸນທີ່ຕ້ອງມີລະຫວ່າງພະລັງງານຊະນິດຕ່າງໆໃນຂະບວນການໃດ ໜຶ່ງ. ເນື່ອງຈາກວ່າ, ໃນລະບົບປິດ [1], ການແລກປ່ຽນພະລັງງານສາມາດໃຫ້ໄດ້ພຽງແຕ່ໂດຍການໂອນຄວາມຮ້ອນ, ຫຼືໂດຍການເຮັດວຽກທີ່ເຮັດ (ໂດຍຫລືໃນລະບົບ), ມັນໄດ້ຖືກສ້າງຕັ້ງຂື້ນວ່າການປ່ຽນແປງຂອງພະລັງງານຂອງລະບົບໃດ ໜຶ່ງ ແມ່ນເທົ່າກັບຜົນລວມຂອງພະລັງງານ ການໂອນຜ່ານຄວາມຮ້ອນແລະຜ່ານການເຮັດວຽກ. ເບິ່ງຮູບສະແດງ 6.
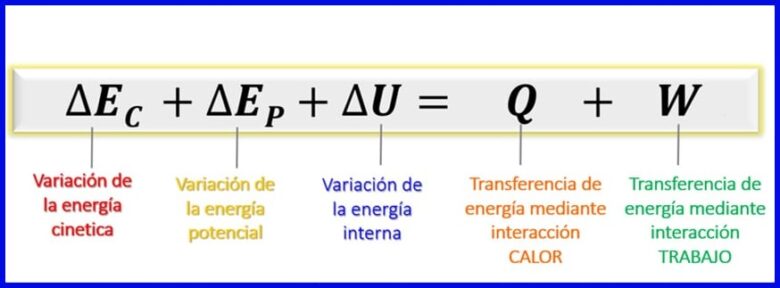
ພິຈາລະນາວ່າພະລັງງານທີ່ຖືກພິຈາລະນາໃນຄວາມສົມດຸນຂອງພະລັງງານນີ້ແມ່ນພະລັງງານ kinetic, ພະລັງງານທີ່ມີທ່າແຮງແລະພະລັງງານພາຍໃນ [1], ຄວາມສົມດຸນຂອງພະລັງງານ ສຳ ລັບລະບົບປິດແມ່ນຍັງຄົງຢູ່ຄືກັບທີ່ສະແດງໃນຮູບ 7
- (ec) ພະລັງງານ Kinetic, ເນື່ອງຈາກການເຄື່ອນໄຫວຂອງຮ່າງກາຍ;
- (ຕອນ) ພະລັງງານທີ່ມີທ່າແຮງ, ເນື່ອງຈາກ ຕຳ ແໜ່ງ ຂອງຮ່າງກາຍໃນສະ ໜາມ ກາວິທັດ;
- (ອ.) ພະລັງງານພາຍໃນ, ເນື່ອງຈາກການປະກອບສ່ວນກ້ອງຈຸລະທັດຂອງພະລັງງານ kinetic ແລະທ່າແຮງຂອງໂມເລກຸນພາຍໃນຂອງຮ່າງກາຍ.
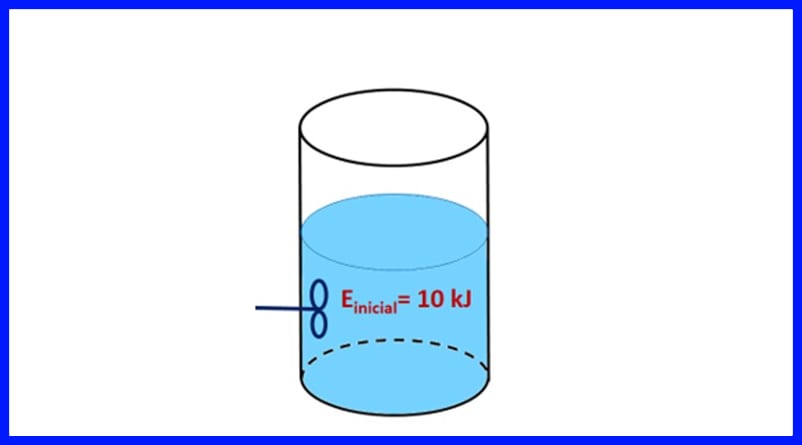
ອອກ ກຳ ລັງກາຍ 1.
ຖັງປິດທີ່ບັນຈຸມີສານ, ເຊິ່ງມີພະລັງງານເລີ່ມຕົ້ນ 10 kJ. ສານດັ່ງກ່າວຖືກປົນກັບເຄື່ອງປັ່ນປ່ວນທີ່ເຮັດວຽກ 500 J ເຮັດວຽກ, ໃນຂະນະທີ່ແຫລ່ງຄວາມຮ້ອນໂອນຄວາມຮ້ອນ 20 kJ ກັບສານດັ່ງກ່າວ. ນອກຈາກນັ້ນ, ຄວາມຮ້ອນ 3kJ ຖືກປ່ອຍອອກສູ່ອາກາດໃນລະຫວ່າງການປະມວນຜົນ. ກຳ ນົດພະລັງງານສຸດທ້າຍຂອງສານ. ເບິ່ງຮູບສະແດງ 8.
Solution:
ໃນຮູບທີ 9 ທ່ານສາມາດເຫັນຄວາມຮ້ອນເພີ່ມໂດຍແຫຼ່ງຄວາມຮ້ອນເຊິ່ງຖືວ່າເປັນ "ບວກ" ເນື່ອງຈາກມັນເພີ່ມພະລັງງານຂອງສານ, ຄວາມຮ້ອນທີ່ປ່ອຍອອກສູ່ອາກາດ, ລົບຍ້ອນວ່າມັນຫຼຸດລົງພະລັງງານຂອງສານ, ແລະ ການເຮັດວຽກຂອງເຄື່ອງປັ່ນປ່ວນ, ເຊິ່ງພະລັງງານທີ່ເພີ່ມຂື້ນໄດ້ຖືສັນຍານໃນທາງບວກ.
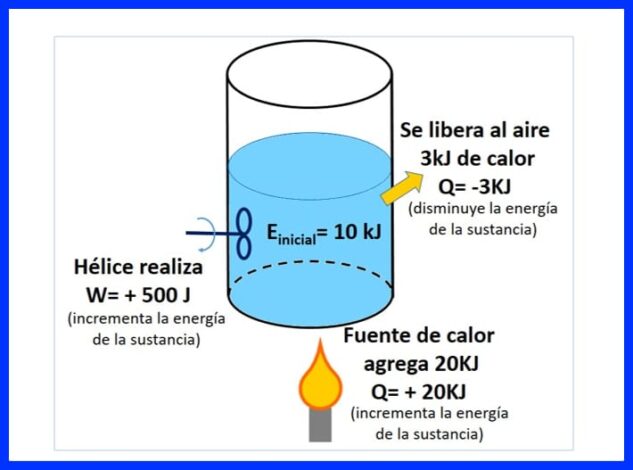
ໃນຮູບທີ 10 ຄວາມສົມດຸນຂອງພະລັງງານຖືກ ນຳ ສະ ເໜີ, ອີງຕາມກົດ ໝາຍ ທຳ ອິດຂອງບາຫຼອດແລະພະລັງງານສຸດທ້າຍຂອງສານແມ່ນໄດ້ຮັບ.

ກົດ ໝາຍ ທີສອງກ່ຽວກັບ thermodynamics
ມີການຖະແຫຼງການຫຼາຍສະບັບຂອງກົດ ໝາຍ ທີ XNUMX ກ່ຽວກັບເຄື່ອງວັດແທກຄວາມຮ້ອນ: ຖະແຫຼງການຂອງ Planck-Kelvin, Clausius, Carnot. ພວກເຂົາແຕ່ລະສະແດງລັກສະນະທີ່ແຕກຕ່າງກັນຂອງກົດ ໝາຍ ທີສອງ. ໂດຍທົ່ວໄປກົດ ໝາຍ ທີສອງກ່ຽວກັບເຄື່ອງວັດແທກອຸນຫະພູມ:
- ທິດທາງຂອງຂະບວນການ thermodynamic, ຄວາມບໍ່ປ່ຽນແປງຂອງປະກົດການທາງດ້ານຮ່າງກາຍ.
- ປະສິດທິພາບຂອງເຄື່ອງເຮັດຄວາມຮ້ອນ.
- ໃສ່ຊັບສິນ "entropy".
ທິດທາງຂອງຂະບວນການ thermodynamic:
ໂດຍ ທຳ ມະຊາດໂດຍ ທຳ ມະຊາດ, ກະແສພະລັງງານຫຼືຖືກຍົກຍ້າຍຈາກລັດທີ່ມີພະລັງງານສູງສຸດໄປສູ່ລັດພະລັງງານຕໍ່າສຸດ. ຄວາມຮ້ອນໄຫລອອກມາຈາກຮ່າງກາຍທີ່ຮ້ອນໄປຫາຮ່າງກາຍທີ່ເຢັນແລະບໍ່ແມ່ນທາງອື່ນທີ່ຢູ່ອ້ອມຂ້າງ. ເບິ່ງຮູບ 11.

ປະສິດທິພາບຫຼືປະສິດທິພາບຄວາມຮ້ອນ:
ອີງຕາມກົດ ໝາຍ ທຳ ອິດຂອງບາຫຼອດ, ພະລັງງານບໍ່ໄດ້ຖືກສ້າງຂື້ນຫລື ທຳ ລາຍ, ແຕ່ວ່າມັນສາມາດຫັນປ່ຽນຫລືໂອນຍ້າຍໄດ້. ແຕ່ວ່າໃນການໂອນພະລັງງານທັງ ໝົດ ຫຼືການຫັນປ່ຽນປະລິມານຂອງມັນບໍ່ມີປະໂຫຍດຫຍັງໃນການເຮັດວຽກ. ໃນຂະນະທີ່ພະລັງງານຖືກຍົກຍ້າຍຫລືປ່ຽນ ໃໝ່, ສ່ວນ ໜຶ່ງ ຂອງພະລັງງານໃນເບື້ອງຕົ້ນຖືກປ່ອຍອອກມາເປັນພະລັງງານຄວາມຮ້ອນ: ພະລັງງານເສື່ອມໂຊມ, ສູນເສຍຄຸນນະພາບ.
ໃນການຫັນເປັນພະລັງງານໃດ ໜຶ່ງ, ຈຳ ນວນພະລັງງານທີ່ໄດ້ຮັບແມ່ນສະເຫມີ ໜ້ອຍ ກ່ວາພະລັງງານທີ່ສະ ໜອງ ໃຫ້. ປະສິດທິພາບຄວາມຮ້ອນແມ່ນປະລິມານຄວາມຮ້ອນຈາກແຫຼ່ງທີ່ຖືກປ່ຽນເປັນວຽກ, ອັດຕາສ່ວນລະຫວ່າງພະລັງງານທີ່ເປັນປະໂຫຍດທີ່ໄດ້ຮັບແລະພະລັງງານທີ່ສະ ໜອງ ໃຫ້ໃນການຫັນເປັນ. ເບິ່ງຮູບ 12.

ເຄື່ອງເຮັດຄວາມຮ້ອນຫລືເຄື່ອງເຮັດຄວາມຮ້ອນ:
ເຄື່ອງເຮັດຄວາມຮ້ອນແມ່ນອຸປະກອນທີ່ປ່ຽນບາງສ່ວນຄວາມຮ້ອນເຂົ້າໃນການເຮັດວຽກຫລືພະລັງງານກົນຈັກ, ເຊິ່ງມັນຕ້ອງການແຫຼ່ງທີ່ສະ ໜອງ ຄວາມຮ້ອນໃນອຸນຫະພູມສູງ.
ໃນເຄື່ອງເຮັດຄວາມຮ້ອນມີສານເຊັ່ນ: ອາຍນ້ ຳ, ອາກາດຫລືເຊື້ອເພີງ. ສານດັ່ງກ່າວໄດ້ຜ່ານການປ່ຽນແປງຂອງອຸນຫະພູມໃນແບບວົງຈອນ, ເພື່ອໃຫ້ເຄື່ອງສາມາດປະຕິບັດງານຢ່າງຕໍ່ເນື່ອງ.
ອອກ ກຳ ລັງກາຍ 2.
ເຄື່ອງຈັກຂອງລົດບັນທຸກຜະລິດຄວາມຮ້ອນໃນການເຜົາ ໄໝ້ ໂດຍການເຜົາຜານນໍ້າມັນເຊື້ອໄຟ. ສໍາລັບແຕ່ລະວົງຈອນຂອງເຄື່ອງຈັກ, ຄວາມຮ້ອນຂອງ 5 kJ ແມ່ນປ່ຽນເປັນ 1kJ ຂອງວຽກກົນຈັກ. ປະສິດທິພາບຂອງມໍເຕີແມ່ນຫຍັງ? ຄວາມຮ້ອນເທົ່າໃດທີ່ປ່ອຍອອກມາໃນແຕ່ລະຮອບຂອງເຄື່ອງຈັກ? ເບິ່ງຮູບ 13
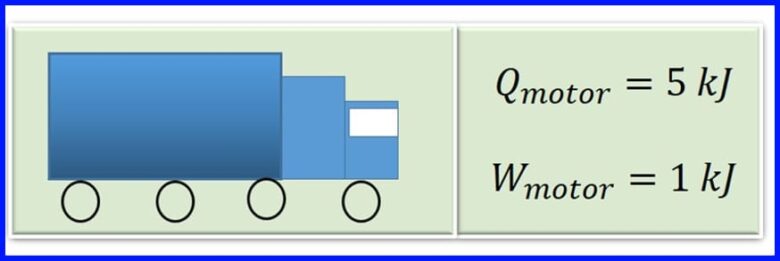
Solution:

ເພື່ອ ກຳ ນົດຄວາມຮ້ອນທີ່ປ່ອຍອອກມາ, ຄາດວ່າໃນເຄື່ອງເຮັດຄວາມຮ້ອນການເຮັດວຽກສຸດທິເທົ່າກັບການໂອນຄວາມຮ້ອນສຸດທິໃຫ້ກັບລະບົບ. ເບິ່ງຮູບ 14.

Entropy:
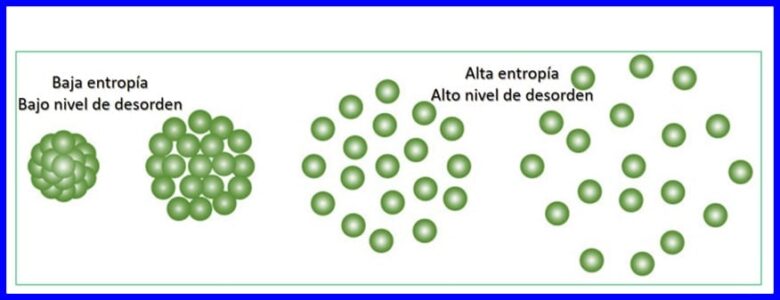
Entropy ແມ່ນລະດັບຂອງການສຸ່ມຫລືຄວາມບໍ່ເປັນລະບຽບໃນລະບົບ. Entropy ເຮັດໃຫ້ມັນສາມາດປະລິມານພາກສ່ວນຂອງພະລັງງານທີ່ບໍ່ສາມາດໃຊ້ເພື່ອຜະລິດວຽກ, ນັ້ນແມ່ນ, ມັນສາມາດເຮັດໃຫ້ສາມາດປະເມີນຄວາມບໍ່ປ່ຽນແປງຂອງຂະບວນການທີ່ມີອຸນຫະພູມໄດ້.
ການໂອນພະລັງງານແຕ່ລະອັນທີ່ເກີດຂື້ນຈະເພີ່ມຄວາມເຂົ້າໃຈຂອງຈັກກະວານແລະຫຼຸດຜ່ອນ ຈຳ ນວນພະລັງງານທີ່ໃຊ້ໄດ້ໃນການເຮັດວຽກ. ທຸກຂະບວນການວັດອຸນຫະພູມຈະ ດຳ ເນີນໄປໃນທິດທາງທີ່ເພີ່ມທະວີຄວາມເຂົ້າໃຈຂອງຈັກກະວານທັງ ໝົດ. ເບິ່ງຮູບ 15.
ກົດ ໝາຍ ວ່າດ້ວຍ Thermodynamics ຄັ້ງທີ 3
ກົດ ໝາຍ ທີສາມຂອງ Thermodynamics ຫຼື Nerst Postulate
ກົດ ໝາຍ ທີສາມຂອງບາຫຼອດແມ່ນກ່ຽວຂ້ອງກັບອຸນຫະພູມແລະຄວາມເຢັນ. ມັນລະບຸວ່າ entropy ຂອງລະບົບທີ່ສູນຢ່າງແທ້ຈິງແມ່ນຄົງທີ່ແນ່ນອນ. ເບິ່ງຮູບສະແດງ 16.
ສູນສົມບູນແມ່ນອຸນຫະພູມຕ່ ຳ ທີ່ສຸດຢູ່ລຸ່ມທີ່ບໍ່ມີມາດຕະການຕ່ ຳ ກວ່າເກົ່າ, ມັນແມ່ນຄວາມ ໜາວ ທີ່ສຸດທີ່ຮ່າງກາຍສາມາດເປັນໄດ້. ສູນຂາດຕົວແມ່ນ 0 K, ເທົ່າກັບ -273,15 ºC.

ສະຫຼຸບ
ມັນມີ XNUMX ຫລັກ ທຳ ບາຫຼອດ. ໃນຫຼັກການສູນມັນໄດ້ຖືກສ້າງຕັ້ງຂື້ນວ່າຄວາມສົມດຸນຄວາມຮ້ອນເກີດຂື້ນເມື່ອສອງຫຼືຫຼາຍຮ່າງກາຍຢູ່ໃນອຸນຫະພູມດຽວກັນ.
ກົດ ໝາຍ ທຳ ອິດຂອງວັດແທກອຸນຫະພູມແມ່ນກ່ຽວຂ້ອງກັບການອະນຸລັກພະລັງງານລະຫວ່າງຂະບວນການຕ່າງໆ, ໃນຂະນະທີ່ກົດ ໝາຍ ທີສອງກ່ຽວກັບເຄື່ອງວັດແທກອຸນຫະພູມກັບລະດັບທິດທາງຕັ້ງແຕ່ຕໍ່າສຸດຫາ entropy ທີ່ສູງທີ່ສຸດ, ແລະປະສິດທິພາບຫລືປະສິດທິພາບຂອງເຄື່ອງຈັກຄວາມຮ້ອນທີ່ປ່ຽນຄວາມຮ້ອນໃຫ້ເປັນວຽກ.
ກົດ ໝາຍ ທີສາມກ່ຽວກັບອຸນຫະພູມແມ່ນກ່ຽວຂ້ອງກັບອຸນຫະພູມແລະຄວາມເຢັນ, ມັນໄດ້ລະບຸວ່າ entropy ຂອງລະບົບທີ່ສູນຢູ່ຢ່າງແນ່ນອນແມ່ນຄົງທີ່ແນ່ນອນ.